题目内容
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ?mol-1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ΔH= -226 kJ?mol-1
下列表述正确的是(NA代表阿伏伽德罗常数的数值)
| A.1molCO燃烧时放出的热量为283 kJ?mol-1 |
| B.Na2O2(s)+CO(g) = Na2CO3(s)ΔH= -509 kJ?mol-1 |
| C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为2NA |
| D.Na2O2和Na2CO3中阴阳离子个数比不同 |
B
解析试题分析:A、1molCO燃烧时放出的热量为283 kJ,单位错误;B、根据盖斯定律,Na2O2(s)+CO(g) = Na2CO3(s) 的?H=1/2?H1+?H2=-509 kJ?mol-1,正确;C、根据化合价的变化,Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为NA,错误;D、Na2O2和Na2CO3中阴阳离子个数比相同,都为2:1,错误。
考点:本题考查化学反应的热效应、电子转移、阴阳离子的判断。

练习册系列答案
相关题目
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
| A.70% | B.52.4% | C.47.6% | D.30% |
下列说法错误的是
| A.仅用KSCN可以检验Fe2+ | B.可以用NaOH溶液检验Fe3+ |
| C.通过化合反应可以得到Fe(OH)3 | D.通过化合反应可以得到FeCl2 |
NaHCO3和Na2O2按1∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
| A.Na2O2和NaHCO3 | B.NaHCO3和Na2CO3 |
| C.NaOH和Na2CO3 | D.只有Na2CO3 |
含有0.20 mol Na2CO3的溶液120mL和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A.1.5 mol/L | B.2.0mol/L | C.0.18 mol/L | D.0.24mol/L |
有关钠的叙述不正确的是( )
| A.少量钠应保存在煤油中,实验后剩余的钠需放回原瓶 |
| B.2.3g钠与97.7g 水反应后溶液中溶质的质量分数大于4% |
| C.钠与CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出的金属铜 |
| D.用一般的化学还原法不能制取金属钠,但可用电解熔化NaCl的方法制得 |
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是: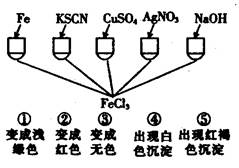
| A.只有④ |
| B.只有③ |
| C.③和④均错 |
| D.全部错误 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)与时间(t)关系如右图。反应中镁和铝的
| A.物质的量之比为3:2 | B.质量之比为3:2 |
| C.摩尔质量之比为2:3 | D.反应速率之比为2:3 |
9.2 g金属钠投入到足量的重水中,则产生的气体中含有( )
| A.0.2 mol中子 | B.0.4 mol电子 | C.0.2 mol质子 | D.0.4 mol分子 |