题目内容
12.周期表中元素的位置、原子结构与元素的性质之间关系密切.下列说法正确的是( )| A. | 锗酸(化学式为H4GeO4),是难溶于水的弱酸 | |
| B. | ①硫酸比次氯酸稳定;②S2-易被氯气氧化,均能说明氯元素的非金属性比硫元素强 | |
| C. | 中学教材所附周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| D. | HF的沸点比HCl 高,是因为H-F键比H-Cl键强 |
分析 A.锗处于Si的下一周期,根据硅酸的性质推断锗酸的性质;
B.次氯酸不是Cl元素的最高价氧化物对应的水化物,不能根据次氯酸的酸性大小判断其非金属性强弱;
C.中学教材所附周期表中第15列元素为ⅤA族元素,根据氮元素的最高价氧化物对应水化物不满足H3RO4;
D.氟化氢和氯化氢都属于分子晶体,其沸点取决于分子间作用力,与共价键强弱无关.
解答 解:A.硅酸为难溶于水的弱酸,Ge和Si处于同一主族,且原子序数Ge>Si,所以锗酸酸性比硅酸弱,且难溶于水,故A正确;
B.②S2-易被氯气氧化,能够说明氯元素的非金属性比硫元素强,但是次氯酸不是Cl元素的最高价含氧酸,不能根据硫酸和次氯酸的酸性大小判断S和Cl的非金属性强弱,应该根据硫酸和高氯酸的酸性大小判断,故B错误;
C.第15列元素为ⅤA族元素,最高价为+5价,N元素的最高价氧化物对应水化物的化学式为HNO3,故C错误;
D.由于氟化氢中含有氢键,所以氟化氢的沸点高于氯化氢,二者的沸点与H-F键、H-Cl键的强弱无关,故D错误;
故选A.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,熟练掌握元素周期律内容为解答关键,注意明确原子结构与元素周期表、元素周期律的关系,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
2.下列关于化学反应限度的叙述错误的是( )
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变温度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变化学反应的限度 | |
| D. | 一个化学反应在一定条件下达到限度时,正、逆反应速率相等 |
3.下列关于有机物的不正确说法是( )
| A. | 油脂是产生能量最高的营养物质 | |
| B. | 苯能发生氧化反应 | |
| C. | 纤维素可在人体内最终水解成葡萄糖 | |
| D. | 谷氨酸分子中含有2种官能团 |
20.只用一种试剂鉴别NH4Cl,K2SO4,(NH4)2SO4,AlCl3、FeCl3五瓶溶液,该试剂是( )
| A. | NaOH | B. | Ba(OH)2 | C. | KSCN | D. | BaCl2 |
7.下列关于碱金属、卤素的描述正确的是( )
| A. | 碱金属在空气中加热均可生成多种氧化物 | |
| B. | 碱金属与水反应,均浮在水面上. | |
| C. | 卤素各单质都能和水剧烈反应. | |
| D. | 卤素单质越活泼,其熔沸点就越低 |
1.向10mL 0.1mol•L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(Al3+) | |
| B. | x=20时,溶液中所发生的反应离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)>c(AlO2-) | |
| D. | 滴加过程中,生成沉淀的最大物质的量为0.003mol |
1.取四等份铝,分别加入足量的下列溶液中,充分反应后,放出氢气最多的是( )
| A. | 3mol/L氨水 | B. | 4mol/L HNO3 | C. | 8mol/L NaOH | D. | 18mol/L H2SO4 |
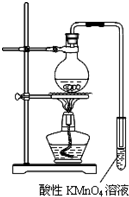 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O