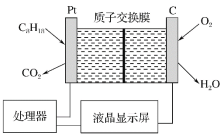
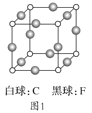
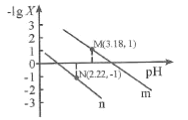
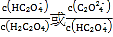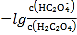题目内容
【题目】(1)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(2)CS2分子中,C原子的杂化轨道类型是_____。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为_____。
(4)CH3COOH中C原子轨道杂化类型为_____。
【答案】V形 sp3 sp V形 sp3 sp3、sp
【解析】
根据价层电子对互拆理论分析中心原子的价层电子对数,并确定其杂化类型和分子的空间构型。
(1)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的价层电子对数为![]() ,由于中心原子只形成2个共价键,故其有2个孤电子对,故其几何构型为V形,中心原子的杂化类型为sp3。
,由于中心原子只形成2个共价键,故其有2个孤电子对,故其几何构型为V形,中心原子的杂化类型为sp3。
(2)CS2分子中,C原子价层电子对数为![]() ,中心原子没有孤电子对,故其杂化轨道类型是sp。
,中心原子没有孤电子对,故其杂化轨道类型是sp。
(3)OF2分子的中心原子的价层电子对数为![]() ,中心原子还有2个孤电子对,故其分子的空间构型为V形,其中氧原子的杂化方式为sp3。
,中心原子还有2个孤电子对,故其分子的空间构型为V形,其中氧原子的杂化方式为sp3。
(4)CH3COOH中C原子有两种,甲基中的碳原子与相邻原子形成4个共用电子对、没有孤电子对,故其轨道杂化类型为sp3;羧基中的碳原子与氧原子形成双键,还分别与甲基上的碳原子、羟基中的氧原子各形成1个共用电子对,没有孤电子对,故其轨道杂化类型为sp2。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】除了酸以外,某些盐也能溶解沉淀。利用如表三种试剂进行实验,相关分析不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
B.向①中加入酚酞显红色说明物质的“不溶性”是相对的
C.向①中加入③沉淀溶解,说明Mg(OH)2比NH3·H2O更难电离
D.①、③混合后发生反应:Mg(OH)2(s)+2NH4+![]() Mg2++2NH3·H2O
Mg2++2NH3·H2O