题目内容
5.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.下列叙述正确的是( )
| A. | 银片为正极,发生的反应为:Ag++e-=Ag | |
| B. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| C. | 取下盐桥,原电池仍可工作 | |
| D. | 在外电路中,电子从正极流向负极 |
分析 镁比银活泼,形成原电池反应时,镁为负极,被还原,电极方程式为Mg-2e-=Mg2+,银为正极,发生还原反应,电极方程式为Ag++e-=Ag,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.
解答 解:A.银不如镁活泼,银为正极,正极发生还原反应,电极方程式为Ag++e-=Ag,故A正确;
B.原电池工作时,阳离子向正极移动,所以琼脂中K+移向AgNO3溶液,故B错误;
C.取出盐桥,不能形成闭合回路,不能产生电流,原电池不能工作,故C错误.
D、在外电路中,电子从负极流向正极,故D错误.
故选A.
点评 本题考查原电池知识,为高频考点,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握金属的活泼性强弱以及电极方程式的书写,难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
15.下列各物质中,化学键类型完全相同的是( )
| A. | Na2O2和NaOH | B. | CH3COONa和NaOH | C. | CCl4和H2O | D. | CO2和H2O2 |
16.如图所示,反应2SO2(g)+O2(g)?2SO3(g);△H<0,在不同温度下、不同压强(p1>p2)下达到平衡,混合气体中SO3的体积分数φ(SO3)随温度变化的曲线应为( )
| A. |  | B. | 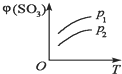 | C. | 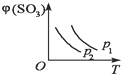 | D. |  |
20.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 常温常压下,16gO2含有的核外电子数为8 NA | |
| B. | 一定条件下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3 NA | |
| C. | 标准状况下,22.4L氨水含有NA个NH3分子 | |
| D. | 28gC2H4中含有C-H键的数目为3 NA |
10.W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,其简单离子都能促进水的电离的是( )
| A. | W2-、X+ | B. | X+、Y3+ | C. | X+、Z2- | D. | Y3+、Z2- |
17.下列说法不正确的是( )
| A. | 加热可鉴别碳酸氢钠与碳酸钠 | |
| B. | 焰色反应可鉴别钾盐和钠盐 | |
| C. | 用水可鉴别氢氧化镁和氢氧化铝固体 | |
| D. | KSCN溶液可鉴别Fe3+与Fe2+ |
13.下列离子方程式书写不正确的是( )
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑ | |
| C. | 氯气制漂白粉:2OH-+Cl2=Cl-+Cl0-+H2O | |
| D. | 氯气和水反应:Cl2+H2O=H++Cl-+HClO |