题目内容
某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。
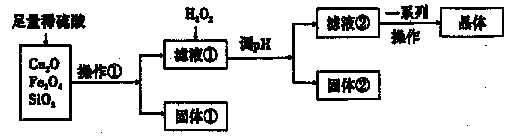
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。 ,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为 。
(4)调pH可选用的药品为____。
A.NaOH溶液 B.CuO C.氨水 D.CuCO3
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是 。
⑴过滤(1分)⑵SiO2、Cu(2分答错0分,答不全1分,下同)⑶2Fe2++H2O2+2H+=2Fe3++2H2O⑷B D (2分)⑸减少CuSO4·5H2O晶体的损失。(2分)
【解析】Cu2O+H2SO4=CuSO4+Cu+H2O,生成蓝色溶液和红色物质铜,Fe3O4 与硫酸反应生成Fe2(SO4)3 和FeSO4,Fe3+ 要与部分Cu反应,SiO2不与H2SO4反应,⑴操作①为过滤,将不溶于酸的SiO2和末反应的铜分离出去,故答案:⑴过滤(1分)⑵SiO2、Cu;⑶将H2O2加入滤液①中,将Fe2+ 氧化成Fe3+ 便于用水解的方法分离,2Fe2++H2O2+2H+=2Fe3++2H2O,答案:2Fe2++H2O2+2H+=2Fe3++2H2O;⑷Fe3+ 沉淀的pH为1.1-3.2,可以用CuO和CuCO3调pH,促进Fe3++3H2O Fe(OH)3
+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。
Fe(OH)3
+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。
考点:实验探究、铜及其化合物

 阅读快车系列答案
阅读快车系列答案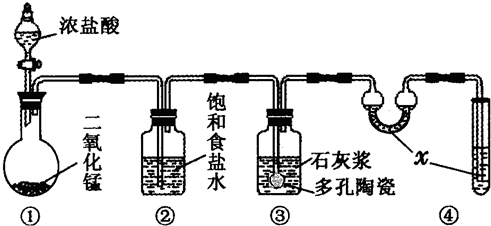


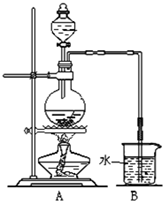 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.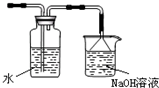 )
)