题目内容
某研究性学习小组利用数字化信息系统研究酸碱中和反应的有关规律.
试剂:0.1000mol?L-1的NaOH标准液,HA和CH3COOH待测液(物质的量浓度相同).
实验:
实验一:用0.1000mol?L-1的NaOH溶液分别滴定20mLHA和20mLCH3COOH,pH的变化情况分别如图Ⅰ和图Ⅱ所示.
实验二:用0.1000mol?L-1的NaOH溶液滴定20mLCH3COOH,溶液的导电能力变化情况如图Ⅲ所示.
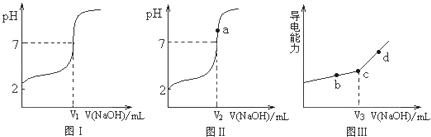
分析通过实验得出的数字化信息,回答下列问题:
(1)实验一中,图Ⅰ和图Ⅱ中两曲线的起点不同,原因是 ;
(2)实验二中,若盛CH3COOH的锥形瓶中有有少量蒸馏水,对图Ⅲ中c点横坐标对应的值V3是否会有影响? ;(填“影响”、“不影响”)
(3)图Ⅰ、图Ⅱ和图Ⅲ中的V1、V2 和V3的大小关系为 ;
(4)图Ⅲ中c点对应溶液的各离子浓度由大到小的排序为 ;
(5)常温下,图Ⅱ中a点对应溶液的pH为8,则溶液中
c(Na+)-c(CH3COO-)的精确值为 mol?L-1;
(6)根据题中的数据,CH3COOH溶液的物质的量浓度c(CH3COOH)= .
试剂:0.1000mol?L-1的NaOH标准液,HA和CH3COOH待测液(物质的量浓度相同).
实验:
实验一:用0.1000mol?L-1的NaOH溶液分别滴定20mLHA和20mLCH3COOH,pH的变化情况分别如图Ⅰ和图Ⅱ所示.
实验二:用0.1000mol?L-1的NaOH溶液滴定20mLCH3COOH,溶液的导电能力变化情况如图Ⅲ所示.

分析通过实验得出的数字化信息,回答下列问题:
(1)实验一中,图Ⅰ和图Ⅱ中两曲线的起点不同,原因是
(2)实验二中,若盛CH3COOH的锥形瓶中有有少量蒸馏水,对图Ⅲ中c点横坐标对应的值V3是否会有影响?
(3)图Ⅰ、图Ⅱ和图Ⅲ中的V1、V2 和V3的大小关系为
(4)图Ⅲ中c点对应溶液的各离子浓度由大到小的排序为
(5)常温下,图Ⅱ中a点对应溶液的pH为8,则溶液中
c(Na+)-c(CH3COO-)的精确值为
(6)根据题中的数据,CH3COOH溶液的物质的量浓度c(CH3COOH)=
分析:(1)依据PH不同,氢离子浓度不同,酸电离程度不同分析判断;
(2)根据c(待测)=
分析;
(3)图Ⅰ酸溶液中氢离子浓度小于10-2mol/L,证明HA是弱酸,图Ⅱ溶液中醋酸溶液中氢离子浓度等于10-2mol/L,图ⅢC点是说明醋酸和NaOH恰好完全反应;
(4)分析图象可知c点是醋酸和氢氧化钠恰好反应生成醋酸钠溶液,依据盐类水解分析判断离子浓度大小;
(5)常温下,图Ⅱ中a点对应溶液的pH为8,c(H+)=10-8mol/L,溶液中c(OH-)=10-6mol/L,结合溶液中电荷守恒分析;
(6)依据图象Ⅲ可知,c点是氢氧化钠和酸恰好反应,依据化学方程式中氢氧化钠物质的量和酸物质的量相同计算得到;
(2)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(3)图Ⅰ酸溶液中氢离子浓度小于10-2mol/L,证明HA是弱酸,图Ⅱ溶液中醋酸溶液中氢离子浓度等于10-2mol/L,图ⅢC点是说明醋酸和NaOH恰好完全反应;
(4)分析图象可知c点是醋酸和氢氧化钠恰好反应生成醋酸钠溶液,依据盐类水解分析判断离子浓度大小;
(5)常温下,图Ⅱ中a点对应溶液的pH为8,c(H+)=10-8mol/L,溶液中c(OH-)=10-6mol/L,结合溶液中电荷守恒分析;
(6)依据图象Ⅲ可知,c点是氢氧化钠和酸恰好反应,依据化学方程式中氢氧化钠物质的量和酸物质的量相同计算得到;
解答:解:(1)图Ⅰ和图Ⅱ中两曲线的起点不同,氢离子浓度不同,HA和CH3COOH待测液物质的量浓度相同,说明酸的电离程度不同,图Ⅰ酸溶液中氢离子浓度小于10-2mol/L,证明HA是弱酸,酸性弱于醋酸,等浓度的HA和CH3COOH,曲线起点不同是因为酸的电离程度不同,氢离子浓度不同;
故答案为:等浓度的HA和CH3COOH,曲线起点不同是因为酸的电离程度不同,氢离子浓度不同,HA酸性弱于醋酸;
(2)锥形瓶中含有少蒸馏水,待测液的物质的量不变,V(标准)不变,根据c(待测)=
,c(待测)不变,若盛CH3COOH的锥形瓶中有有少量蒸馏水,对图Ⅲ中c点横坐标对应的值V3无影响;
故答案为:无影响;
(3)图Ⅰ酸溶液中氢离子浓度小于10-2mol/L,证明HA是弱酸,酸性弱于醋酸,生成盐水解程度大,达到PH=7需要的氢氧化钠溶液体积小于醋酸,溶液中存在盐和酸,图Ⅱ溶液中醋酸溶液中氢离子浓度等于10-2mol/L,达到中性溶质为醋酸和醋酸钠,图ⅢC点是说明醋酸和NaOH恰好完全反应,所以得到消耗氢氧化钠溶液体积大小为V1<V2<V3 ;
故答案为:V1<V2<V3 ;
(4)图中c点,说明醋酸和NaOH恰好完全反应,醋酸钠水解,使得c(Na+)>c(CH3COO-),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)常温下,图Ⅱ中a点对应溶液的pH为8,c(H+)=10-8mol/L,溶液中c(OH-)=10-6mol/L,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)得到,c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6mol/L-10-6mol/L=9.9×10-7mol/L;
故答案为:9.9×10-7mol/L;
(6)依据图象Ⅲ计算醋酸浓度,因为图象Ⅲ中c点是醋酸和氢氧化钠溶液恰好反应,依据化学方程式计算,NaOH+CH3COOH=CH3COONa+H2O,0.1000mol/L×V3×10-3L=c(CH3COOH)×0.02L,c(CH3COOH)=
mol/L;
故答案为:
mol/L;
故答案为:等浓度的HA和CH3COOH,曲线起点不同是因为酸的电离程度不同,氢离子浓度不同,HA酸性弱于醋酸;
(2)锥形瓶中含有少蒸馏水,待测液的物质的量不变,V(标准)不变,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:无影响;
(3)图Ⅰ酸溶液中氢离子浓度小于10-2mol/L,证明HA是弱酸,酸性弱于醋酸,生成盐水解程度大,达到PH=7需要的氢氧化钠溶液体积小于醋酸,溶液中存在盐和酸,图Ⅱ溶液中醋酸溶液中氢离子浓度等于10-2mol/L,达到中性溶质为醋酸和醋酸钠,图ⅢC点是说明醋酸和NaOH恰好完全反应,所以得到消耗氢氧化钠溶液体积大小为V1<V2<V3 ;
故答案为:V1<V2<V3 ;
(4)图中c点,说明醋酸和NaOH恰好完全反应,醋酸钠水解,使得c(Na+)>c(CH3COO-),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)常温下,图Ⅱ中a点对应溶液的pH为8,c(H+)=10-8mol/L,溶液中c(OH-)=10-6mol/L,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)得到,c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6mol/L-10-6mol/L=9.9×10-7mol/L;
故答案为:9.9×10-7mol/L;
(6)依据图象Ⅲ计算醋酸浓度,因为图象Ⅲ中c点是醋酸和氢氧化钠溶液恰好反应,依据化学方程式计算,NaOH+CH3COOH=CH3COONa+H2O,0.1000mol/L×V3×10-3L=c(CH3COOH)×0.02L,c(CH3COOH)=
| 0.100V3 |
| 20 |
故答案为:
| 0.100V3 |
| 20 |
点评:本题考查了酸碱反应过程分析判断,图象分析理解应用,溶液中离子浓度大小比较,电荷守恒的分析应用是关键,题目难度中等.

练习册系列答案
相关题目
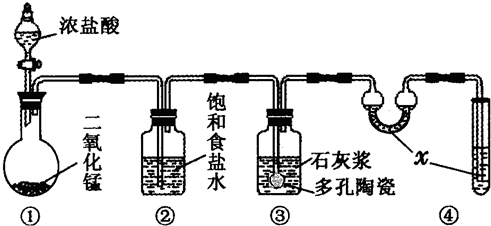


 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验. )
)