题目内容
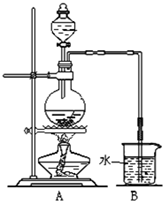
某研究性学习小组利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数.下图是测定装置的示意图,A中的试剂是盐酸.

请同答下列问题:
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是 .
(2)试剂C是水,其作用是 .
(3)试剂D是 ,其作用是干燥氧气.
(4)连接好装置后的实验操作依次是 (填下列操作序号).
①检验氢气纯度 ②加热E ③检验装置气密性
④点燃G管溢出的气体 ⑤从A瓶逐滴滴加液体
(5)从实验中测得了下列数据:
①空E管的质量a;
②E管和试样的总质量b;
④反应后E管和内盛物的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d;
⑤反应后F管及内盛物的总质量e.
由以上数据可以列出计算混合粉末中铜元素的质量分数的两个不同计算式,其中较简单的是 .
(6)已知:C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1Cu2O(s)+
O2(g)
2CuO(s)△H=-145kJ?mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方 .

请同答下列问题:
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是
(2)试剂C是水,其作用是
(3)试剂D是
(4)连接好装置后的实验操作依次是
①检验氢气纯度 ②加热E ③检验装置气密性
④点燃G管溢出的气体 ⑤从A瓶逐滴滴加液体
(5)从实验中测得了下列数据:
①空E管的质量a;
②E管和试样的总质量b;
④反应后E管和内盛物的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d;
⑤反应后F管及内盛物的总质量e.
由以上数据可以列出计算混合粉末中铜元素的质量分数的两个不同计算式,其中较简单的是
(6)已知:C(s)+
| 1 |
| 2 |
| 1 |
| 2 |
| ||
. |
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方
分析:(1)利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数,分析装置可知烧瓶中装入的试剂是锌粒,分液漏斗加入的是稀盐酸,发生装置是制备氢气的作用,据此写出离子方程式;
(2)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置C为水;
(3)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置D为浓硫酸;
(4)装置连接后的操作顺序是先检验装置气密性,从A瓶逐滴滴加液体盐酸发生反应生成氢气,检验装置中氢气纯度防止混有空气加热爆炸,点燃G管溢出的气体,加热E玻璃管;
(5)c-a为还原后铜的质量,b-a为铜的氧化物的质量;
(6)依据热化学方程式和盖斯定律计算得到;
(2)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置C为水;
(3)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置D为浓硫酸;
(4)装置连接后的操作顺序是先检验装置气密性,从A瓶逐滴滴加液体盐酸发生反应生成氢气,检验装置中氢气纯度防止混有空气加热爆炸,点燃G管溢出的气体,加热E玻璃管;
(5)c-a为还原后铜的质量,b-a为铜的氧化物的质量;
(6)依据热化学方程式和盖斯定律计算得到;
解答:解:(1)利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数,分析装置可知烧瓶中装入的试剂是锌粒,分液漏斗加入的是稀盐酸,发生装置是制备氢气的作用,反应的离子方程式为:Zn+2H+=Zn2++H2↑;
故答案为;Zn+2H+=Zn2++H2↑;
(2)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置C为水;
故答案为:除去氢气中的氯化氢气体;
(3)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置D为浓硫酸;
故答案为:浓硫酸;
(4)装置连接后的操作顺序是先检验装置气密性,从A瓶逐滴滴加液体盐酸发生反应生成氢气,检验装置中氢气纯度防止混有空气加热爆炸,点燃G管溢出的气体,加热E玻璃管;装置连接顺序为③⑤①④②;
故答案为:③⑤①④②;
(5)分析数据和装置特征分析可知最简单的计算是利用c-a为氧化铜、氧化亚铜被还原生成的铜质量,b-a为氧化铜和氧化亚铜的质量,进而得到铜元素的质量分数的计算式=
×100%;
故答案为:
×100%;
(6)①C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1 ②Cu2O(s)+
O2(g)=2Cu(s)△H=-145kJ?mol-1
依据盖斯定律
①-②得到的热化学方程式2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol;
故答案为;2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol;
故答案为;Zn+2H+=Zn2++H2↑;
(2)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置C为水;
故答案为:除去氢气中的氯化氢气体;
(3)制备的氢气中含有氯化氢和水蒸气,需要用水吸收氯化氢,浓硫酸吸收水蒸气,装置D为浓硫酸;
故答案为:浓硫酸;
(4)装置连接后的操作顺序是先检验装置气密性,从A瓶逐滴滴加液体盐酸发生反应生成氢气,检验装置中氢气纯度防止混有空气加热爆炸,点燃G管溢出的气体,加热E玻璃管;装置连接顺序为③⑤①④②;
故答案为:③⑤①④②;
(5)分析数据和装置特征分析可知最简单的计算是利用c-a为氧化铜、氧化亚铜被还原生成的铜质量,b-a为氧化铜和氧化亚铜的质量,进而得到铜元素的质量分数的计算式=
| c-a |
| b-a |
故答案为:
| c-a |
| b-a |
(6)①C(s)+
| 1 |
| 2 |
| 1 |
| 2 |
依据盖斯定律
①-②得到的热化学方程式2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol;
故答案为;2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol;
点评:本题考查了实验探究物质性质的装置分析判断,反应过程的连接分析应用,主要是物质性质和含量的定量分析和测定,题目难度中等.

练习册系列答案
相关题目
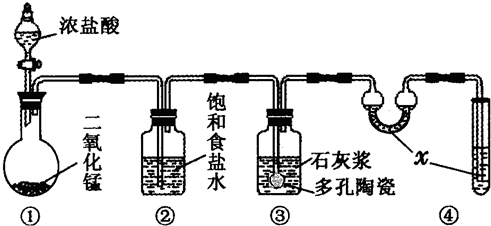


 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验. )
)