题目内容
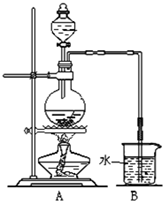
某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:

(1)装置中试管B的作用是
(2)实验中可观察到石英管A中的现象为
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生.写出该反应的化学方程式
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:

( i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
( ii)下列有关步骤④的操作中说法正确的是
a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为

(1)装置中试管B的作用是
防止倒吸
防止倒吸
.(2)实验中可观察到石英管A中的现象为
左侧固体由红棕色逐渐变为黑色,右侧白色粉末变为蓝色
左侧固体由红棕色逐渐变为黑色,右侧白色粉末变为蓝色
.(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生.写出该反应的化学方程式
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O+2H2O
| △ |
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O+2H2O
.| △ |
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:

( i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
250ml的容量瓶
250ml的容量瓶
.( ii)下列有关步骤④的操作中说法正确的是
ce
ce
.a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为
77.78%
77.78%
.分析:(1)在实验条件下,A中生成的乙醛呈气态,在C中被冷却,造成实验装置内压强降低.
(2)现象是反应的体现,乙醇在A中与氧化铁反应生成乙醛、铁、水,硫酸铜吸水呈蓝色.
(3)乙醛有还原性,被新制的氢氧化铜氧化乙酸,氢氧化铜被还原为氧化亚铜.
(4)( i)准确稀释到250ml,应使用比较精确的定量仪器.
( ii)步骤④的操作目的是通过滴定确定20mlB溶液中铁离子的物质的量,进而测定反应后石英管A左侧固体中铁元素的含量.
a、滴定反应为铁离子氧化碘离子,为碘单质,反应开始就会生成碘单质.
b、不润洗滴定管,直接装液导致溶液浓度降低.
c、锥形瓶不需要用待测夜润洗
d、滴定过程中,眼睛注视锥形瓶内颜色变化,以判断反应到终点.
e、30s内溶液不恢复原来的颜色,说明反应到终点,才可读记录.
(iii)根据铁原子守恒,通过关系式求算.
(2)现象是反应的体现,乙醇在A中与氧化铁反应生成乙醛、铁、水,硫酸铜吸水呈蓝色.
(3)乙醛有还原性,被新制的氢氧化铜氧化乙酸,氢氧化铜被还原为氧化亚铜.
(4)( i)准确稀释到250ml,应使用比较精确的定量仪器.
( ii)步骤④的操作目的是通过滴定确定20mlB溶液中铁离子的物质的量,进而测定反应后石英管A左侧固体中铁元素的含量.
a、滴定反应为铁离子氧化碘离子,为碘单质,反应开始就会生成碘单质.
b、不润洗滴定管,直接装液导致溶液浓度降低.
c、锥形瓶不需要用待测夜润洗
d、滴定过程中,眼睛注视锥形瓶内颜色变化,以判断反应到终点.
e、30s内溶液不恢复原来的颜色,说明反应到终点,才可读记录.
(iii)根据铁原子守恒,通过关系式求算.
解答:解:(1)在实验条件下,A中生成的乙醛呈气态,在C中被冷却,造成实验装置内压强降低,溶液倒吸,产生危险,所以试管B的作用是防止倒吸.
故答案为:防止倒吸
(2)乙醇在A中反应为CH3CH2OH+Fe2O3
CH3CHO+H2O+2FeO,Fe2O3变为FeO,固体由红棕色逐渐变为黑色,反应有水生成,硫酸铜吸水变为蓝色.所以现象为左侧固体由红棕色逐渐变为黑色,右侧白色粉末变为蓝色.
故答案为:左侧固体由红棕色逐渐变为黑色,右侧白色粉末变为蓝色
(3)乙醛有还原性,被新制的氢氧化铜氧化乙酸,氢氧化铜被还原为氧化亚铜,
反应方程式为CH3CHO+2Cu(OH)2
CH3COOH+Cu2O+2H2O
故答案为:CH3CHO+2Cu(OH)2
CH3COOH+Cu2O+2H2O
(4)( i)准确稀释到250ml,应使用比较精确的定量容器,故还应用250ml的容量瓶.
故答案为:250ml的容量瓶
( ii)a、滴定反应为铁离子氧化碘离子,为碘单质,反应开始就会生成碘单质,如用淀粉作指示剂,即使未到终点,溶液也变蓝色,故a错误;
b、不润洗滴定管,直接装液导致溶液浓度降低,测量不准确,故b错误;
c、锥形瓶不需要用待测夜润洗,故c正确;
d、滴定过程中,眼睛注视锥形瓶内颜色变化,以判断反应到终点,故d错误;
e、30s内溶液不恢复原来的颜色,说明反应到终点,才可读记录,故e正确.
故选:ce
(iii)根据铁原子守恒,铁离子与碘离子的反应可得如下关系式
石英管A左侧9g固体中Fe~~~~Fe3+~~~~~~I-
1 1
n 0.5mol/L×0.02L×
所以n=0.5mol/L×0.02L×
=0.125mol,
所以石英管A左侧固体中铁元素的百分含量为
×100%=77.78%
故答案为:77.78%
故答案为:防止倒吸
(2)乙醇在A中反应为CH3CH2OH+Fe2O3
| △ |
故答案为:左侧固体由红棕色逐渐变为黑色,右侧白色粉末变为蓝色
(3)乙醛有还原性,被新制的氢氧化铜氧化乙酸,氢氧化铜被还原为氧化亚铜,
反应方程式为CH3CHO+2Cu(OH)2
| △ |
故答案为:CH3CHO+2Cu(OH)2
| △ |
(4)( i)准确稀释到250ml,应使用比较精确的定量容器,故还应用250ml的容量瓶.
故答案为:250ml的容量瓶
( ii)a、滴定反应为铁离子氧化碘离子,为碘单质,反应开始就会生成碘单质,如用淀粉作指示剂,即使未到终点,溶液也变蓝色,故a错误;
b、不润洗滴定管,直接装液导致溶液浓度降低,测量不准确,故b错误;
c、锥形瓶不需要用待测夜润洗,故c正确;
d、滴定过程中,眼睛注视锥形瓶内颜色变化,以判断反应到终点,故d错误;
e、30s内溶液不恢复原来的颜色,说明反应到终点,才可读记录,故e正确.
故选:ce
(iii)根据铁原子守恒,铁离子与碘离子的反应可得如下关系式
石英管A左侧9g固体中Fe~~~~Fe3+~~~~~~I-
1 1
n 0.5mol/L×0.02L×
| 250ml |
| 20ml |
所以n=0.5mol/L×0.02L×
| 250ml |
| 20ml |
所以石英管A左侧固体中铁元素的百分含量为
| 0.125mol×56g/mol |
| 9.000g |
故答案为:77.78%
点评:以乙醇的性质为载体考查实验,综合性较大,涉及实验装置理解、滴定实验原理、仪器选择、化学计算等,难度较高,对所掌握的知识要熟练掌握,迁移运用.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
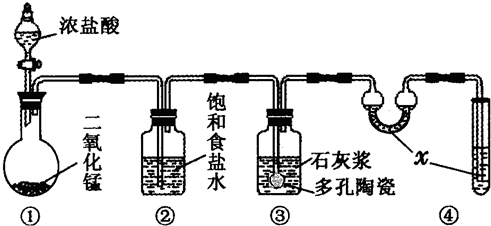
 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验. )
)