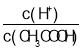题目内容
【题目】原电池是化学对人类的一项重大贡献。
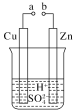
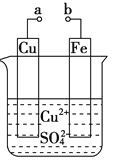
(1)某兴趣小组为研究原电池原理,设计如图装置。
①a和b不连接时,烧杯中发生反应的离子方程式是__________________。
②a和b用导线连接,Cu极为原电池__极(填“正”或“负”),该电极反应式是_,溶液中的H+移向_____(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
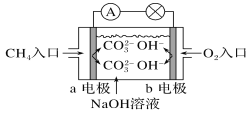
①电池的负极是_______(填“a”或“b”)电极,该极的电极反应式为: ________
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)
【答案】Zn+2H+=Zn2++H2↑ 正 2H++2e-=H2↑ Cu 6.5 a CH4+10OH--8e-=CO![]() +7H2O 减小
+7H2O 减小
【解析】
(2)根据图示可知CH4转化为CO![]() 发生氧化反应,所以通入CH4的一极为负极,通入氧气的一极为正极。
发生氧化反应,所以通入CH4的一极为负极,通入氧气的一极为正极。
(1)①a和b不连接时,烧杯中发生锌与硫酸的置换反应,离子方程式为Zn+2H+=Zn2++H2↑;
②a和b用导线连接,Cu电极上发生氢离子得电子的还原反应,为原电池的正极;电极反应式为2H++2e-=H2↑;原电池中阳离子流向正极,所以氢离子移向Cu极;
③无论是否连接a和b,Zn都发生Zn-2e-=Zn2+,所以转移0.2mol电子时,有0.1molZn转化为Zn2+,质量减轻0.1mol×65g/mol=6.5g;
(2)①该电池中CH4失电子发生氧化反应,所以a电极为负极;电解质溶液为碱性,所以电极反应式为CH4+10OH--8e-=CO![]() +7H2O;
+7H2O;
②甲烷燃料电池的总反应式为CH4+2O2+2OH-= CO![]() +3H2O,反应中OH-参加反应导致溶液中c(OH-)减小,溶液的pH减小。
+3H2O,反应中OH-参加反应导致溶液中c(OH-)减小,溶液的pH减小。

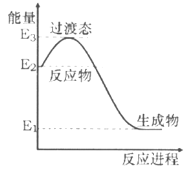
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)写出H2CO3电离方程式_________平衡常数表达式Ka1(H2CO3)=__________________
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________
(3)①CH3COO-、②HCO3-、③CO32-、④ClO-结合H+的能力由强到弱的顺序为(注意:用序号①、②、③、④作答)____________________
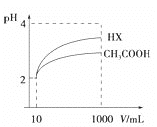
(4)体积为10mLpH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。
(5)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式_____________
【题目】下列实验操作能达到实验目的的是()
实验目的 | 实验操作 | |
A | 除去MgCl2溶液中的少量FeCl3 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后,过滤 |
B | 验证乙醇和浓硫酸可以制备乙烯 | 乙醇和浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 |
C | 比较HClO和CH3COOH酸性 | 用pH试纸测定浓度均为0.1mol/L的HClO溶液和CH3COOH溶液的pH |
D | Mg(OH)2可溶解于饱和NH4Cl溶液 | 将NH4Cl固体与Mg(OH)2混合 |
A.AB.BC.CD.D