题目内容
13.在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH (l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 kJ•mol-1.分析 0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则1mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出704kJ的热量.
解答 解:0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则1mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出704kJ的热量,热化学反应方程式为:CH3OH (l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 kJ•mol-1,
故答案为:CH3OH (l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,注意把握热化学方程式的意义,题目较简单.

练习册系列答案
相关题目
3.以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图.下列说法正确的是( )
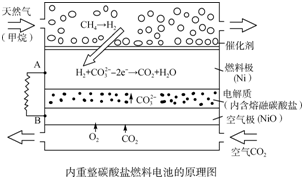

| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO${\;}_{3}^{2-}$ |
1.常温下,浓度为0.1mol/L的一元酸HA溶液的pH=2.0,浓度为0.1mol/L的一元碱BOH溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-12.将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是( )
| A. | c(OH-)>c(H+)>c(B+)>c(A-) | B. | c(B+)>c(A-)>c(H+)>c(OH-) | ||
| C. | c(B+)>c(A-)>c(OH-)>c(H+) | D. | c(A-)>c(B+)>c(H+)>c(OH-) |
18.水是生命之源,下列有关水的说法正确的是( )
| A. | 将河水经过沉淀、过滤、活性炭吸附等净化处理后,所得的水就是纯水 | |
| B. | 水是一种常见的溶液 | |
| C. | 煮沸可以降低自来水的硬度 | |
| D. | 电解水实验说明水是由氢气和氧气组成的 |
2.下列对物质用途的描述中,错误的是( )
| A. | 镁铝合金密度较小、强度高,常用作制造航天器的材料 | |
| B. | Cl2、SO2、NaClO均可用于漂白 | |
| C. | 浓硫酸具有吸水性,可用于干燥HCl、H2S、O2 | |
| D. | 可通过铝热反应冶炼某些熔点较高的金属 |
3.根据所提供的资料,写出有关元素的名称和符号.
| 元素 | 资料 | 名称 | 符号 |
| A | 核电荷数为8 | ||
| B | 原子核内有11个质子 | ||
| C | 原子核外有18个电子 | ||
| D | 微粒D+核外电子排布为2、8、8 |