题目内容
2.下列对物质用途的描述中,错误的是( )| A. | 镁铝合金密度较小、强度高,常用作制造航天器的材料 | |
| B. | Cl2、SO2、NaClO均可用于漂白 | |
| C. | 浓硫酸具有吸水性,可用于干燥HCl、H2S、O2 | |
| D. | 可通过铝热反应冶炼某些熔点较高的金属 |
分析 A.合金的性质是:硬度大,熔点低,耐腐蚀等;
B.氯气中的次氯酸、SO2、NaClO可水解生成次氯酸均有漂白性;
C.硫化氢有还原性;
D.利用铝热反应冶炼金属,利用了铝的强还原性.
解答 解:A.合金的性质是:硬度大,熔点低,耐腐蚀等,可用作制造航天器的材料,故A正确;
B.氯气中的次氯酸、SO2、NaClO可水解生成次氯酸均有漂白性,可用于漂白,故B正确;
C.硫化氢有还原性,能被浓硫酸氧化,故C错误;
D.铝为活泼金属,可用于冶炼金属,故D正确.
故选C.
点评 本题考查合金、漂白性、氧化还原反应以及铝热反应等,难度不大,注意可通过铝热反应冶炼某些熔点较高的金属.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
17.检验钢质设备完好性的方法之一是:在被怀疑有裂纹处涂上6mol/L盐酸,过一段时间若观察到有粗线裂纹,表明该处原先确有看不见的细裂纹,产生粗裂纹的主要原因是( )
| A. | 原裂纹处有碳积存 | |
| B. | 裂纹处表面积很大,反应快 | |
| C. | 裂纹处的尘埃起催化作用 | |
| D. | 裂纹处有氧化铁积存,并与盐酸作用生成可溶性氯化物 |
7.现有FeS和Fe(OH)3的混合物28.3克,与足量稀硫酸反应,生成沉淀1.6克混合物中含有Fe(OH)3的质量可能为( )
| A. | 10.7g | B. | 21.4g | C. | 23.9g | D. | 40g |
14.下列微粒电子式书写错误的是( )
| A. |  | B. | Na+ | C. | 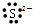 | D. | 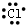 |
11.下列情况与盐类的水解无关的是( )
| A. | 泡沫灭火器中的反应原理 | |
| B. | 草木灰(主要成分K2CO3)作为农作物肥料不能与铵态氮肥混用 | |
| C. | 明矾和漂白粉常作为抗洪救灾物质 | |
| D. | CuSO4可使蛋白质变性 |
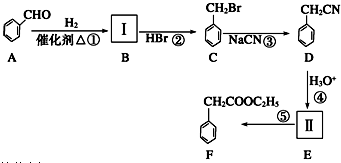
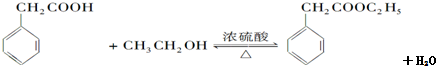 (要求写出反应条件).
(要求写出反应条件). (要求写出反应条件).
(要求写出反应条件). .
.