题目内容
4.实验室用自来水制取蒸馏水时:在蒸馏烧瓶中加入约$\frac{1}{3}$体积的自来水,再加入几粒碎瓷片,其作用是防止加热时出现暴沸.使用的玻璃仪器中,冷凝管的作用是将水蒸气冷凝成液态水.分析 实验室用自来水制取蒸馏水的方法是:加热自来水使其汽化,然后利用冷凝管冷凝即可得到,在蒸馏烧瓶中盛约$\frac{1}{3}$体积的自来水,不能加入过多液体,防止液体溢出,并放入几粒沸石,防止液体剧烈沸腾引起液体飞溅,据此解答.
解答 解:在蒸馏烧瓶中盛约$\frac{1}{3}$体积的自来水,不能加入过多液体,防止液体溢出,并放入几粒沸石,防止液体剧烈沸腾引起液体飞溅,利用冷凝管将水蒸气冷凝成液态水,
故答案为:$\frac{1}{3}$;碎瓷片;冷凝管.
点评 本题考查了实验室制取冷凝水,熟悉蒸馏实验的原理和装置及仪器使用的注意事项是解题关键,题目难度不大.

练习册系列答案
 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
14.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
回下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+
(2)每转移0.04mol电子,理论消耗Zn1.3g.(Zn的摩尔质量=65g/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+,加碱调节PH为2.7,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全).继续加碱调节PH为6,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加双氧水的后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
溶解度/(g/100g水)
| 温度0C化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+
(2)每转移0.04mol电子,理论消耗Zn1.3g.(Zn的摩尔质量=65g/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+,加碱调节PH为2.7,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全).继续加碱调节PH为6,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加双氧水的后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
15.常温下,下列各组数据中的比值小于2:1的是( )
| A. | K2CO3溶液中c(K+)与c(CO32-)之比 | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的KOH溶液与pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比 |
19.下列有关氯元素及其化合物的表示正确的是( )
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: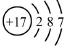 | |
| C. | 氯分子的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
16.如表操作不能达到目的是( )
| 选项 | 目的 | 操作 |
| A | 配制100 mL 1.0 mol/L CuSO4溶液 | 将25 g CuSO4•5H20溶于100 mL蒸馏水中 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的浓溶液,冷却结晶,过滤、洗涤 |
| C | 检验某溶液中是否含硫酸根 | 向溶液中先加盐酸后加氯化钡 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
14.下列微粒电子式书写错误的是( )
| A. |  | B. | Na+ | C. | 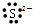 | D. | 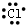 |
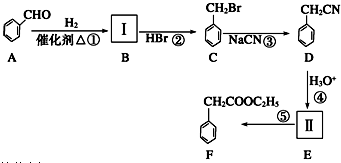
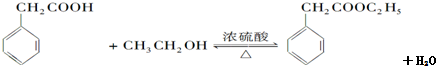 (要求写出反应条件).
(要求写出反应条件). (要求写出反应条件).
(要求写出反应条件). .
.