题目内容
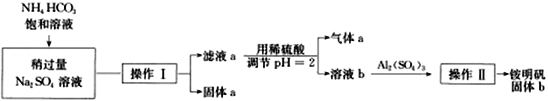
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体[NH4Al(SO4)2]的工艺流程如图所示:
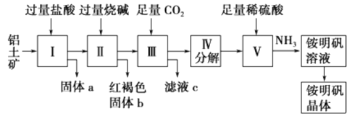
请回答下列问题:
(1)固体a的化学式为________,固体b化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为__________________。
(3)由Ⅰ→Ⅱ→Ⅲ→Ⅳ都要用到的分离方法是__________________,由铵明矾溶液中制铵明矾晶体的操作是__________________。
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__________。
【答案】SiO2 Fe(OH)3 ![]() +CO2+2H2O===
+CO2+2H2O===![]() +Al(OH)3↓ Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O 过滤 蒸发浓缩、冷却结晶、过滤洗涤 Fe2O3
+Al(OH)3↓ Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O 过滤 蒸发浓缩、冷却结晶、过滤洗涤 Fe2O3
【解析】
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2;铝土矿中Al2O3和Fe2O3能溶于盐酸,生成铁离子和铝离子,加入过量的烧碱,铝离子变为NaAlO2溶液,反应的离子方程式为:铁离子生成氢氧化铁沉淀,所以固体b化学式为Fe(OH)3;Ⅲ中偏铝酸钠溶液通入足量CO2气体生成氢氧化铝沉淀,反应的离子方程式为AlO2- +CO2+2H2O===HCO3-+Al(OH)3↓。
综上所述,本题答案是:SiO2;Fe(OH)3;AlO2- +CO2+2H2O===HCO3-+Al(OH)3↓。
(2)根据流程可知,Al(OH)3分解生成Al2O3,Al2O3与稀硫酸、氨气反应生成铵明矾溶液,反应的化学方程式为:Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O;
综上所述,本题答案是:Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O。
(3)根据流程可知,Ⅰ→Ⅱ→Ⅲ→Ⅳ操作中都涉及到了固液分离操作,所以Ⅰ→Ⅱ→Ⅲ→Ⅳ都要用到的分离方法是过滤;从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤。
综上所述,本题答案是:过滤 ;蒸发浓缩、冷却结晶、过滤、洗涤。
(4) 铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质),如果先向铝土矿加入过量氢氧化钠,氧化铝、二氧化硅均溶于强碱溶液生成偏铝酸钠和硅酸钠溶液,氧化铁不溶与氢氧化钠,此时首先出现的固体a是 Fe2O3;
综上所述,本题答案是:Fe2O3。

 阅读快车系列答案
阅读快车系列答案【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:
![]()
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填上或下),分液后用____________(填入字母编号)洗涤。
a KMnO4溶液 b 稀H2SO4 c Na2CO3溶液
②再通过____________(填操作名称)即可得到精品。