题目内容
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g)=2CH3OH(g)ΔH2=+23.4 kJ·mol-1
(1)反应2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
(2)一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填字母)。
a.正反应速率先增大后减小 b.H2的转化率增大
c.生成物的体积百分含量增大 d.容器中的![]() 值变小
值变小
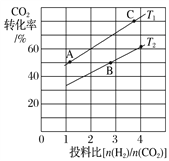
(3)在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。T1温度下,将4mol CO2和8 mol H2充入2 L的密闭容器中,10min 后反应达到平衡状态,则0~10min内的平均反应速率v(CH3OCH3)=________________;KA、KB、KC三者之间的大小关系为____________________。
【答案】 -130.8 ab 0.06mol·L-1·min-1 KA=KC>KB
【解析】(1)已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1,②CH3OCH3(g)+H2O(g)═2CH3OH(g) △H2=+23.4kJmol-1,根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H3=2△H1-△H2=2×(-53.7kJmol-1)-23.4kJmol-1 =-130.8kJmol-1,故答案为:-130.8;
(2)①a.正反应速率先增大后减小,可能是增大反应物浓度,平衡正向移动,故a正确;b.H2的转化率增大,平衡一定正向移动,故b正确;c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,故c错误;d.容器中的![]() 变小,可能是减小二氧化碳物质的量,平衡逆向移动,故d错误;故答案为:ab;
变小,可能是减小二氧化碳物质的量,平衡逆向移动,故d错误;故答案为:ab;
(3)T1温度下,将4molCO2和8molH2充入2L的密闭容器中,由图象可知,10min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为4mol×60%×![]() =1.2mol,所以平均反应速率v(CH3OCH3)=
=1.2mol,所以平均反应速率v(CH3OCH3)= 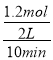 =0.06molL-1min-1 ;平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度比T2温度大,则KA=KC>KB,故答案为:0.06 mol/(Lmin);KA=KC>KB。
=0.06molL-1min-1 ;平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度比T2温度大,则KA=KC>KB,故答案为:0.06 mol/(Lmin);KA=KC>KB。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案