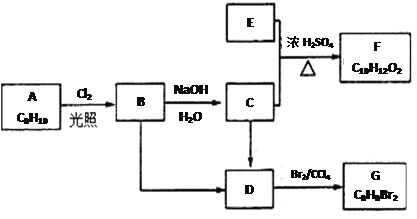
题目内容
【题目】用NA表示阿伏加德罗常数,下列说有关说法正确的是
A. 在常温常压下,11.2L N2含有的分子数小于0.5NA
B. 标准状况下,2.24L SO3含有的原子数为0.4NA
C. 将1L 2mol/L的FeCl3溶液,其中含有Cl-为2NA
D. 46g NO2和N2O4混合气体所含氧原子数目有可能为3NA
【答案】A
【解析】
试题A.依据气体摩尔体积的条件分析判断,标准状况气体摩尔体积为22.4L/ mol,在常温常压下,温度升高分子间距离增大,11.2L N2含有的分子数小于0.5NA,故A正确;B.标准状况三氧化硫不是气体,2.24L SO3含物质的量不是0.1 mol,故B错误;C.胶体是氢氧化铁的集合体,将1L 2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数小于2NA,故C错误;D.NO2和N2O4混合气体最简比为NO2,依据n=计算NO2中氧原子数目=![]() ×2×NA=2NA,故D错误;选A。
×2×NA=2NA,故D错误;选A。

【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:______________________________________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的_________________。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)==CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/(kJ·mol-1) | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①图1中曲线a到曲线b的措施是_________。

②已知CO中的C与O之间为叁键,其键能为x kJ/mol,则x=________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为______________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为________。
(4)电解水蒸气和CO2产生合成气(H2
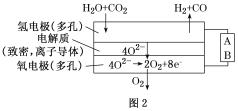
【题目】关于下列实验的说法不正确的是:
操作 | 现象 |
| ①铜片溶解,溶液变蓝,起始产生红棕色气体,气体颜色逐渐变淡,直至无色,在管口处变为淡棕色 ②铜片继续溶解,产生无色气体,在管口处变为淡棕色 |
A. 实验中产生红棕色气体,说明浓HNO3具有氧化性
B. 在整个实验过程中,发生的反应多于2个
C. ②中产生无色气体,说明盐酸有氧化性
D. 若将铜片换成铁片,则①中没有明显实验现象。
【题目】为探究影响化学反应速率的因素:在25mL 5%的H2O2溶液中,如表格中条件,产生等体积氧气时,所消耗时间最短的是:
组别 | V(1mol/L FeCl3)/mL | 蒸馏水/mL | 温度/℃ |
A | 2 | 2 | 50 |
B | 3 | 1 | 40 |
C | 2 | 2 | 40 |
D | 3 | 1 | 50 |
A.AB.BC.CD.D