题目内容
| ||
| 高温高压 |
(1)下列事实中,不能说明上述可逆反应已经达到平衡的是
①N2、H2、NH3的体积分数不再改变
②单位时间内生成2n molNH3的同时生成3n molH2O
③单位时间内生成3n molN-H键的同时生成n mol N≡N
④用N2、H2O、NH3的物质的量浓度变化表示的反应速度之比为1:3:2
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2.00L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①0~1小时内N2的平均反应速度率为
②此温度下该反应的化学平衡常数K=
③反应达到平衡后,若往平衡体系中再加入N2、H2O、NH3各1mol,化学平衡向
(2)①根据氨气的物质的量计算出消耗的氮气的物质的量,再根据v=
| △c |
| △t |
②根据3、4小时的时间段氨气的物质的量不变,说明达到了平衡状态,根据氨气的物质的量计算出消耗的氮气和氢气的物质的量及平衡时的浓度,再根据平衡常数表达式K=
| c2(NH3) |
| c(N2)?c(H2)3 |
③根据加入氨气、水和氨气后的浓度商判断平衡移动方向.
②单位时间内生成2n molNH3的同时生成3n molH2O,表示的是正逆反应速率,且相等,表明达到了平衡状态,故②错误;
③单位时间内生成3n molN-H键的同时生成n mol N≡N,表示的都是逆反应速率,无法判断正逆反应速率是否相等,故③正确;
④用N2、H2O、NH3的物质的量浓度变化表示的反应速度之比为1:3:2,反应速率始终与化学计量数成正比,无法判断是否达到平衡状态,故④正确;
⑤反应方程式两边都是气体,气体的质量不变,反应两边气体的体积不相等,所以中气体的物质的量是变化的量,反应过程中平均摩尔质量是变化的量,混合气体的平均摩尔质量不再改变,说明正逆反应速率相等,达到了平衡状态,故⑤错误;
⑥反应方程式两边气体的体积不相等,所以反应过程中气体的物质的量会发生变化,若混合气体的总物质的量不再改变,说明正逆反应速率相等,达到了平衡状态,故⑥错误;
故选③④;
(2)①0~1小时内生成了0.2mol氨气,根据反应N2(g)+3H2(g)?2NH3(g),消耗了氮气的物质的量为:n(N2)=
| 1 |
| 2 |
| ||
| 1h |
故答案为:0.0500;
②根据表中数据可知,反应在第3和4小时时间段内氨气的物质的量不变,说明达到了平衡状态,此时生成了1.00mol氨气,
列出化学平衡的三段式为 N2(g)+3H2(g)?2NH3(g),
反应开始前(mol) 1.5 4.5 0
变化量(mol) 0.5 1.5 1
平衡时(mol) 1 3 1
平衡时各组分的浓度为:c(N2)=
| 1mol |
| 2.00 |
| 3mol |
| 2.00L |
| 1mol |
| 2.00L |
此温度下该反应的化学平衡常数K=
| c2(NH3) |
| c(N2)?c(H2)3 |
| (0.500)2 |
| (1.500)3×(0.500) |
故答案为:0.15;
③反应达到平衡后,若往平衡体系中再加入N2、H2O、NH3各1mol,此时各组分的浓度为:c(N2)=
| 1.00mol+1.00mol |
| 2.00L |
| 3.00mol+1.00mol |
| 2.00L |
| 1.00mol+1.00mol |
| 2.00L |
| c2(NH3) |
| c(N2)?c(H2)3 |
| (1.00)2 |
| (2.00)3?(1.00) |
故答案为:正反应.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
(1)实验室中常用来制备氨气的化学方程式为
(2)已知H2(g)的燃烧热为285.8kJ?mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是
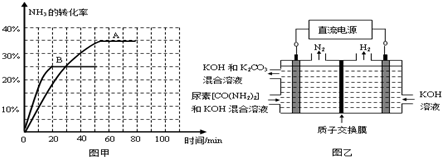
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气.该装置中阳极的电极反应式为
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g)
△H=一92. 4 KJ·mol-1
2NH3(g)
△H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g)
+3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g)
+3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
A.①③④ B.①②④⑤ C.①④⑤ D.②③④
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。

t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
|
时间/min |
0 |
30 |
70 |
80 |
100 |
|
n(CO2) /mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。

⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标
况),则消耗的尿素为 g(忽略气体的溶解)。







 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1