��Ŀ����
��Դ�Ŀ������������������Ŀɳ�����չϢϢ��أ�������ú���Դ�ǰ���������ǰ���ش���⡣
����֪����Fe2O3(s)��3C(ʯī)��2Fe(s)��3CO(g) ��H��a kJ��mol��1
��CO(g)��l/2O2(g)��CO2(g) ��H��b kJ��mol��1
��C(ʯī)��O2(g)��CO2(g) ��H��c kJ��mol��1
��Ӧ4Fe(s)��3O2(g)��2Fe2O3(s)���ʱ䦤H�� kJ��mol��1��
������ԭ��صĹ���ԭ�������л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص��� �������)��
A��C(s)��CO2(g)��2CO(g) ��H��0 B��NaOH(aq)��HCl(aq)��NaCl(aq)��H2O(l) ��H��0
C��2H2O(l)��2H2(g)��O2(g) ��H��0 D��CH4(g)��2O2(g)��CO2(g)��2H2O(l) ��H��0
����ϡ����Ϊ�������Һ�����ԭ��ص�������ӦʽΪ ��
��������Ϊһ����ɫ��Դ����������������뷢չ����ʮ����Ҫ�����塣
��1��ʵ���ã���ͨ������£�1 g H2��ȫȼ������Һ̬ˮ���ų�142.9 kJ��������H2ȼ�յ��Ȼ�ѧ����ʽΪ ��
��2���������ϳɰ����Ȼ�ѧ����ʽΪN2(g)��3H2(g)  2NH3(g) ��H����92.4 kJ��mol��1
2NH3(g) ��H����92.4 kJ��mol��1
��һ�������£�������������˵���÷�Ӧ�Ѵ�ƽ��״̬���� ��
A������(N2)������(NH3)
B�������ʵ����ʵ������
C�������������ʵ������ٱ仯
D�����������ܶȲ��ٱ仯
����ͼ��ʾ�ϳɰ���Ӧ�ﵽƽ���ÿ��ֻ�ı��¶ȡ�ѹǿ�������е�ijһ��������Ӧ���ʦ���ʱ��t�Ĺ�ϵ�����б�ʾƽ�������е�NH3�ĺ�����ߵ�һ��ʱ���� ��ͼ��t3ʱ�ı������������ ��

���¶�ΪT��ʱ����4a mol H2��2a mol N2����0.5 L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50%����Ӧ��ƽ�ⳣ��Ϊ ��
��. 6c��6b��2a ��. D O2��4H+��4e��=2H2O
��.��1��2H2(g) +O2(g)
= 2H2O(l) ��H=��571.6kJ/mol ��2���� C ��t2~t3 �����¶�
��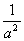 (mol/L)-2
(mol/L)-2
��������
�����������(��+��)��6-�١�2�÷�Ӧ4Fe(s)��3O2(g)��2Fe2O3(s)���ʱ䦤H��(6c��6b��2a )kJ/mol. ��.���ܹ���ԭ��أ���Ӧ����Ϊ������ԭ��Ӧ����Ϊ���ȷ�Ӧ��ֻ��D��������������ϡ����Ϊ�������Һ�����ԭ��ص�������ӦʽΪO2��4H+��4e��=2H2O�������ĵ缫ʽΪCH4-8e-+2H2O= CO2+8H+����1��H2ȼ�յ��Ȼ�ѧ����ʽΪ2H2(g) +O2(g) = 2H2O(l)
��H=��571.6kJ/mol����2����A�����κ�ʱ�̦���(N2)������(NH3)=1:2������(NH3)=2����(N2)��������(N2)=����(NH3)�������(NH3)=2����(NH3)����Ӧδ�ﵽƽ�⡣����B. �����ʵ����ʵ������,��ʱ���Ƿ�Ӧ��һ�����������������ܴﵽƽ�⣬Ҳ����Ϊ�ﵽƽ�⡣����C. �������������ʵ������ٱ仯��˵���κ����ʵ����ĵ�Ũ���������Ũ�Ȳ��䣬��Ӧ�ﵽƽ�⡣��ȷ��D�����������ݻ����䣬�κ�ʱ�̻��������ܶȲ��ٱ仯������˵����Ӧ�ﵽƽ�⡣������Ϊ��ѹ���������������ܶȲ��ٱ仯��˵����Ӧ�ﵽƽ�⡣��Ӧ������������ʲ���˵����Ӧ�Ƿ�ﵽƽ�⡣���ڴ�t0��t1��Ӧƽ�⣬��t1ʱ������ѹǿ��V����V��������V������ö࣬ƽ�������ƶ�����t2ʱ�̴ﵽ�µ�ƽ��״̬����t2��t3���ָ�ƽ�⣻��t3ʱ�������¶ȣ�V����V��������V������ö࣬ƽ�������ƶ����ﵽt4ʱ�̴ﵽ��һ���µ�ƽ��״̬����t4��t5���ָ�ƽ�⣻��t5ʱ�̼��������V����V�����������������ͬ��ƽ��û�з����ƶ������Ա�ʾƽ�������е�NH3�ĺ�����ߵ�һ��ʱ����t2��t3��ͼ��t3ʱ�ı�������������¶ȡ����ڷ�Ӧ��ʼ��n(H2)=4amol,n(N2)=2amol,����ƽ��ʱN2��ת����Ϊ50%�����Դ�ʱn(N2)=1amol ; n(H2)=amol,n(NH3)=2amol.
��Ӧ��ƽ�ⳣ��Ϊ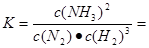
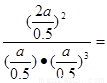
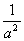 (mol/L)-2.
(mol/L)-2.
���㣺�����˹���ɵ�Ӧ�á��Ȼ�ѧ����ʽ����д����ѧƽ��״̬���жϡ����������ƽ���Ӱ�켰��ѧƽ�ⳣ���ļ����֪ʶ��

 ��У����ϵ�д�
��У����ϵ�д� ���ܼ��������ǵ�����ϢϢ��أ�������ܼ�����ÿһλ����Ӧ�����������оٴ벻������һҪ����ǣ�������
���ܼ��������ǵ�����ϢϢ��أ�������ܼ�����ÿһλ����Ӧ�����������оٴ벻������һҪ����ǣ�������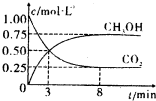 ��2012?��ׯ��ģ��̼��̼�Ļ����������������������е�Ӧ�÷dz��㷺����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�
��2012?��ׯ��ģ��̼��̼�Ļ����������������������е�Ӧ�÷dz��㷺����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�



