题目内容
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
(1)实验室中常用来制备氨气的化学方程式为
(2)已知H2(g)的燃烧热为285.8kJ?mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将
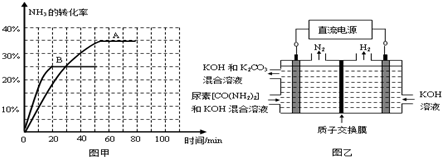
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气.该装置中阳极的电极反应式为
分析:(1)实验室中常用来制备氨气,是用固体氯化铵和固体烧碱混合加热制得,装置同实验室制氧气的装相似,这里需要注意的是不要随意的将铵盐和碱换成NH4NO3和NaOH;
(2)将已知热化学方程式和氢气的燃烧热的热化学方程式,综合利用盖斯定律求解;
(3)滴加氨水的过程中,氨水电离产生的OH-对水的电离平衡起抑制作用;可知根据电荷守恒,求溶液中铵根离子的物质的量;
(4)①化学平衡建立是从反应物投料建立平衡状态的,所以从开始到平衡反应物的浓度在不断减少,浓度越小速率越小;
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3相当给原平体系加压;
③第一问题考查平衡图象的绘制,利用三段式计算出30min时NH3的转化率为20%,70min时NH3的转化率为30%,然后模仿已有曲线绘制出曲线,注意70min前的图象不能画成直线;
④第一个问题是电极反应式的书写,首先从价态变化上,判断阳极上产生氮气,然后根据化合价的变化和电子得失守恒,电荷守恒,书写出电极反应式.
(2)将已知热化学方程式和氢气的燃烧热的热化学方程式,综合利用盖斯定律求解;
(3)滴加氨水的过程中,氨水电离产生的OH-对水的电离平衡起抑制作用;可知根据电荷守恒,求溶液中铵根离子的物质的量;
(4)①化学平衡建立是从反应物投料建立平衡状态的,所以从开始到平衡反应物的浓度在不断减少,浓度越小速率越小;
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3相当给原平体系加压;
③第一问题考查平衡图象的绘制,利用三段式计算出30min时NH3的转化率为20%,70min时NH3的转化率为30%,然后模仿已有曲线绘制出曲线,注意70min前的图象不能画成直线;
④第一个问题是电极反应式的书写,首先从价态变化上,判断阳极上产生氮气,然后根据化合价的变化和电子得失守恒,电荷守恒,书写出电极反应式.
解答:解:(1)实验室制备氨气的方法是加热氯化铵和熟石灰的固体混合物,方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)NH3(g)在纯氧中燃烧生成无毒、无害物质量氮气,的热化学方程式,实际上是考查盖斯定律的应用,根据H2(g)的燃烧热为285.8kJ?mol-1,即H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ?mol-1…①,再结合已知的:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1…②
(①×3-②)×2即可得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530 kJ?mol -1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530 kJ?mol -1;
(3)①向(NH4)2SO4溶液中滴加稀氨水的过程中水的电离平衡受到抑制,H2O?H++OH-,加入酸和碱平衡逆向移动,因此加氨水对水的电离起逆向移动;由amol(NH4)2SO4溶于水,向该溶液中滴加VL稀氨水后溶液呈中性可知,c(OH-)=10-7mol/L,设平衡时NH3?H2O的物质的量为x,溶液的体积为b,
则:NH3?H2O?NH4++OH-
x/b 2a/b 10-7
由电离平衡常数可知:
=2×10-5解之得:x=a/100,则c(NH3?H2O)=a/100V,
故答案为:逆向;a/100V;
(4)①从表中的数据可知:80min时已经达到平衡,v逆(H2O)=v正(H2O)=v正(CO2),而20min时未达到平衡,v正(CO2)大于80min时v正(CO2),因此:20min时v正(CO2)大于80min时v逆(H2O),
故答案为:>;
②第一次投料是0.10molCO2和0.40molNH3,第二次投料是0.15molCO2和0.60molNH3,第二次投料建立的平衡状态相当于再第一次投料建立平衡的基础上再加压,平衡正向移动,因此CO2的转化率将增大,故答案为:增大;
③利用三段式计算出30min时NH3的转化率为20%,70min时NH3的转化率为30%,然后模仿已有曲线绘制出曲线,注意70min前的图象不能画成直线,无论是吸热还是放热反应,温度升高时,达到平衡的时间都会缩短;该反应是放热反应,温度升高,平衡会逆向移动,所以NH3的转化率会减小,故答案为:B;
④电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,总反应:CO(NH2)2+2OH-=CO32-+N2↑+3H2↑
即 1molCO(NH2)2 ~4mol气体,
60g 89.6L
15g 22.4L,
故答案为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O;15.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)NH3(g)在纯氧中燃烧生成无毒、无害物质量氮气,的热化学方程式,实际上是考查盖斯定律的应用,根据H2(g)的燃烧热为285.8kJ?mol-1,即H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ?mol-1…①,再结合已知的:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1…②
(①×3-②)×2即可得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530 kJ?mol -1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530 kJ?mol -1;
(3)①向(NH4)2SO4溶液中滴加稀氨水的过程中水的电离平衡受到抑制,H2O?H++OH-,加入酸和碱平衡逆向移动,因此加氨水对水的电离起逆向移动;由amol(NH4)2SO4溶于水,向该溶液中滴加VL稀氨水后溶液呈中性可知,c(OH-)=10-7mol/L,设平衡时NH3?H2O的物质的量为x,溶液的体积为b,
则:NH3?H2O?NH4++OH-
x/b 2a/b 10-7
由电离平衡常数可知:
| ||
|
故答案为:逆向;a/100V;
(4)①从表中的数据可知:80min时已经达到平衡,v逆(H2O)=v正(H2O)=v正(CO2),而20min时未达到平衡,v正(CO2)大于80min时v正(CO2),因此:20min时v正(CO2)大于80min时v逆(H2O),
故答案为:>;
②第一次投料是0.10molCO2和0.40molNH3,第二次投料是0.15molCO2和0.60molNH3,第二次投料建立的平衡状态相当于再第一次投料建立平衡的基础上再加压,平衡正向移动,因此CO2的转化率将增大,故答案为:增大;
③利用三段式计算出30min时NH3的转化率为20%,70min时NH3的转化率为30%,然后模仿已有曲线绘制出曲线,注意70min前的图象不能画成直线,无论是吸热还是放热反应,温度升高时,达到平衡的时间都会缩短;该反应是放热反应,温度升高,平衡会逆向移动,所以NH3的转化率会减小,故答案为:B;
④电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,总反应:CO(NH2)2+2OH-=CO32-+N2↑+3H2↑
即 1molCO(NH2)2 ~4mol气体,
60g 89.6L
15g 22.4L,
故答案为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O;15.
点评:本题考查氨气的实验室制法的原理、盖斯定律的应用、化学平衡的移动、电离平衡常数、等效平衡和电化学的相关知识,夸度大,涉及的知识点多,但难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
氨气是一种重要的化工原料.下列关于氨气性质的描述不正确的是( )
| A、无色 | B、无味 | C、易液化 | D、极易溶于水 |
 氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.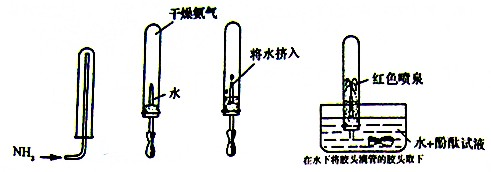
 氨气是一种重要的化工原料.完成下列填空:
氨气是一种重要的化工原料.完成下列填空: