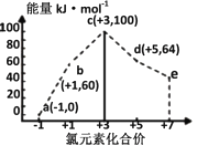
题目内容
【题目】酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图所示,

电池总反应可表示为:2H2+O2== 2H2O,下列有关说法错误的是
A. H![]() 由b极通过固体酸电解质传递到a极
由b极通过固体酸电解质传递到a极
B. b极上的电极反应式为:O2+4H![]() +4e
+4e![]() == 2H2O
== 2H2O
C. 每转移0.4 mol电子,生成3.6g水
D. 电子通过外电路从a极流向b极
【答案】A
【解析】
根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水,据此回答判断.
A.原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故A错误;
B.该电池为酸性电池,所以正极电极反应为O2+4e-+4H+=2H2O,故B正确;
C.每转移0.4mol电子,生成0.2mol水,质量是0.2mol×18g/mol=3.6g,故C正确;
D.a为负极,b是正极,则电子应该是通过外电路由a极流向b,故D正确;故答案为A。

【题目】I、下图是全钒液流电池的示意图
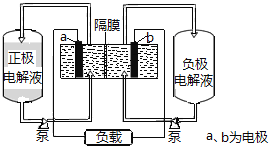
该电池充放电的总反应式为:
![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。
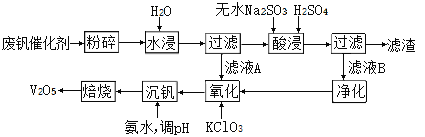
(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;上述过滤操作过程中所需用到的玻璃仪器有__________________________________。
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。