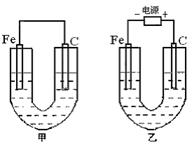
题目内容
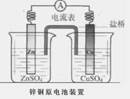
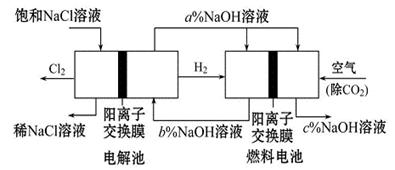
有下图所示装置:
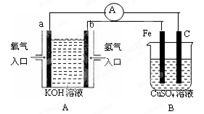
(1)装置A中b为 极,电极反应式为 ,a极反应式为 ;
(2)装置B中C为 极,电极反应式为 。
(3)当铁电极的质量变化为12.8g时,a极上消耗O2在标准状况下的体积为 L。
(4)若将装置B中的CuSO4溶液更换为100mL滴有酚酞的饱和NaCl溶液,电解一段时间后 极附近颜色变红,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 。
(5)若将装置B改为电解精炼铜,则粗铜作 极,另一极反应为 。

(1)装置A中b为 极,电极反应式为 ,a极反应式为 ;
(2)装置B中C为 极,电极反应式为 。
(3)当铁电极的质量变化为12.8g时,a极上消耗O2在标准状况下的体积为 L。
(4)若将装置B中的CuSO4溶液更换为100mL滴有酚酞的饱和NaCl溶液,电解一段时间后 极附近颜色变红,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 。
(5)若将装置B改为电解精炼铜,则粗铜作 极,另一极反应为 。
(1)负 2H2-4e-+4OH-=4H2O。O2+4e-+2H2O =4OH-。 (2) 阳 4OH--4e- = O2↑+2H2O
(3) 2.24L。 (4) 阴 14 ( 5) 阳 Cu2++2e-=Cu。
(3) 2.24L。 (4) 阴 14 ( 5) 阳 Cu2++2e-=Cu。
试题分析:装置A为原电池,其中b是负极,电极反应式是2H2-4e-+4OH-=4H2O;电极a是正极,电极反应式是O2+4e-+2H2O =4OH-。装置B为电解池,其中C为阳极,电极反应式为4OH--4e- = O2↑+2H2O。n(Cu)=12.8g÷64g/mol=0.2mol.n(e-)=0.4mol.n(O2)=0.1mol.所以V(O2)=2.24L.(4)电解100mL滴有酚酞的饱和NaCl溶液,的方程式为:2NaCl+2H2O
 2NaOH+Cl2↑+H2↑.由于电解时H+在阴极放电产生氢气逸出,破坏了附近的水的电离平衡促使水继续电离,最后达到电离平衡,结果C(OH-)>C(H+),溶液呈碱性。故一段时间后在阴极附近溶液的颜色变为红色。若n(H2)= 0.05mol,n(OH-)="0.1mol." C(OH-)=" 0.1mol" ÷0.1L=1mol/L所以C(H+)="Kw/" C(OH-)=10-14mol/L,所以PH="14." (5)若将装置B改为电解精炼铜,则粗铜作阳极,另一极反应为Cu2++2e-=Cu。
2NaOH+Cl2↑+H2↑.由于电解时H+在阴极放电产生氢气逸出,破坏了附近的水的电离平衡促使水继续电离,最后达到电离平衡,结果C(OH-)>C(H+),溶液呈碱性。故一段时间后在阴极附近溶液的颜色变为红色。若n(H2)= 0.05mol,n(OH-)="0.1mol." C(OH-)=" 0.1mol" ÷0.1L=1mol/L所以C(H+)="Kw/" C(OH-)=10-14mol/L,所以PH="14." (5)若将装置B改为电解精炼铜,则粗铜作阳极,另一极反应为Cu2++2e-=Cu。
练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
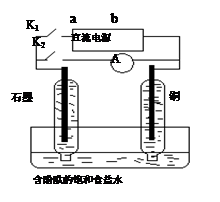
 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池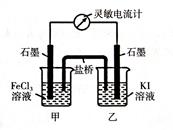
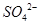 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
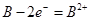
 Cl2↑+H2↑
Cl2↑+H2↑