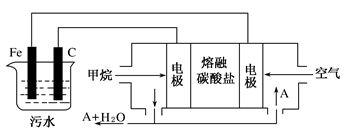
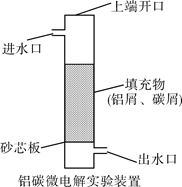
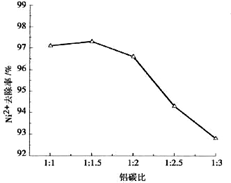
题目内容
I.现将反应2Fe3+ + 2I- 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池
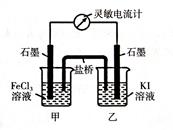
(1)能说明反应达到平衡的标志是__________;(填序号)
a.电流计读数为零
b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂-饱和KCl溶液,反应过程中的Cl-移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时___________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为____________________________。
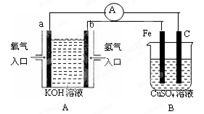
II.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。
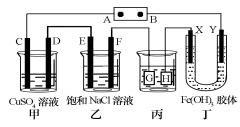
(4)装置乙中电极F的电极反应式____________________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为____________________;
(6)欲用装置丙进行粗铜精炼,电极G应该是____________________;
(7)装置丁中电极_______附近红褐色变深,说明氢氧化铁胶粒带正电荷。
 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池
(1)能说明反应达到平衡的标志是__________;(填序号)
a.电流计读数为零
b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂-饱和KCl溶液,反应过程中的Cl-移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时___________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为____________________________。
II.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。

(4)装置乙中电极F的电极反应式____________________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为____________________;
(6)欲用装置丙进行粗铜精炼,电极G应该是____________________;
(7)装置丁中电极_______附近红褐色变深,说明氢氧化铁胶粒带正电荷。
(1)a(2)乙(3)甲,2Fe2+-2e-= 2Fe3+
(4)2H+ + 2e-= H2↑(5)1:2(6)粗铜(7)Y
(4)2H+ + 2e-= H2↑(5)1:2(6)粗铜(7)Y
试题分析:(1)根据常温下能自动发生的氧化还原反应都可设计成原电池,再利用正反应2Fe3++2I-?2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极,利用负极发生氧化反应,正极发生还原反应,当电流计为零时,说明没有电子发生转移,则反应达到平衡,故a正确;(2)阴离子向正极移动,故反应过程中的Cl-移向乙烧杯;(3)当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,发生氧化反应,电极反应方程式为2Fe2+-2e-= 2Fe3+;(4)根据图片知,该装置是电解池,将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,电极反应式2H+ + 2e-= H2↑;(5)甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,生成1mol氧气需要4mol电子,生成1mol铜时需要2mol,电子所以转移相同物质的量的电子时生成单质的物质的量之比为1:2;(6)若用装置丙进行粗铜精炼,电镀时,镀层作阳极,镀件作阴极,故G为粗铜;(7)电解池中带正电荷的微粒向阴极移动,带负电荷的微粒向阳极移动,Y为阴电极,故电极Y附近红褐色变深。

练习册系列答案
相关题目
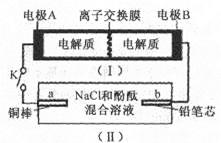
 闭合开关K时,b极附近先变红色。下列说法正确的是
闭合开关K时,b极附近先变红色。下列说法正确的是