题目内容
已知25℃时有关弱酸的电离平衡常数:
则下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、等物质的量浓度的各溶液 pH 关系为:pH( NaCN)>pH(Na2CO3)>pH( CH3COONa) |
| B、浓度均为0.2mol/L NaHCO3和 Na2CO3溶液中,存在的粒子种类不相同 |
| C、0.4mol?L-1 HCN 溶液与 0.2mol?L-1 NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+) |
| D、25℃时,pH=4且浓度均为0.1 mol?L-1的CH3COOH、CH3COONa混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.酸的电离平衡常数越大,酸电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小;
B.碳酸氢钠能发生电离和水解,碳酸钠能发生两步水解;
C.二者等体积混合后,溶液中的溶质为等物质的量浓度的NaCN、HCN,HCN的电离平衡常数为4.9×10-10,NaCN的水解平衡常数为
=2×10-5,则电离程度小于水解程度,混合溶液呈碱性;
D.混合溶液呈酸性,醋酸的电离程度大于醋酸根离子水解程度,根据电荷守恒和物料守恒判断.
B.碳酸氢钠能发生电离和水解,碳酸钠能发生两步水解;
C.二者等体积混合后,溶液中的溶质为等物质的量浓度的NaCN、HCN,HCN的电离平衡常数为4.9×10-10,NaCN的水解平衡常数为
| 10-14 |
| 4.9×10-10 |
D.混合溶液呈酸性,醋酸的电离程度大于醋酸根离子水解程度,根据电荷守恒和物料守恒判断.
解答:
解:A.酸的电离平衡常数越大,酸电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,电离平衡常数:CH3COOH>HCN>HCO3-,则水解程度CO32->CN->CH3COO-,所以相同浓度的钠盐溶液pH大小顺序是pH(Na2CO3)>pH( NaCN)>pH( CH3COONa),故A错误;
B.碳酸氢钠能发生电离和水解,碳酸钠能发生两步水解,碳酸氢钠中存在HCO3-?H++OH-、HCO3-+H2O?H2CO3+OH-、H2O?H ++OH-,碳酸钠中存在CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-、H2O?H ++OH-,所以两种溶液中存在的粒子种类相同,都有Na+、CO32-、HCO3-、H2CO3、H+、OH-、H2O,故B错误;
C.二者等体积混合后,溶液中的溶质为等物质的量浓度的NaCN、HCN,HCN的电离平衡常数为4.9×10-10,NaCN的水解平衡常数为
=2×10-5,则电离程度小于水解程度,混合溶液呈碱性,则c(OH-)>c(H+),钠离子不水解,则溶液中离子浓度大小顺序是c(Na+)>c(OH-)>c(H+),故C正确;
D.混合溶液呈酸性,醋酸的电离程度大于醋酸根离子水解程度,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈酸性,则c(OH-)很小,所以醋酸电离程度较小,大部分以分子存在,所以c(Na+)+c(H+)<c(CH3COO-)+c(CH3COOH),故D错误;
故选C.
B.碳酸氢钠能发生电离和水解,碳酸钠能发生两步水解,碳酸氢钠中存在HCO3-?H++OH-、HCO3-+H2O?H2CO3+OH-、H2O?H ++OH-,碳酸钠中存在CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-、H2O?H ++OH-,所以两种溶液中存在的粒子种类相同,都有Na+、CO32-、HCO3-、H2CO3、H+、OH-、H2O,故B错误;
C.二者等体积混合后,溶液中的溶质为等物质的量浓度的NaCN、HCN,HCN的电离平衡常数为4.9×10-10,NaCN的水解平衡常数为
| 10-14 |
| 4.9×10-10 |
D.混合溶液呈酸性,醋酸的电离程度大于醋酸根离子水解程度,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈酸性,则c(OH-)很小,所以醋酸电离程度较小,大部分以分子存在,所以c(Na+)+c(H+)<c(CH3COO-)+c(CH3COOH),故D错误;
故选C.
点评:本题考查了弱电解质的电离和盐类水解,明确酸的电离平衡常数与酸根离子水解程度的关系是解本题关键,注意C中水解平衡常数的计算方法,从而确定溶液酸碱性,题目难度中等.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
现有A、B、C、D四种溶液,它们分别是NaCl溶液、Na2CO3溶液、NH3?H2O、稀盐酸中的一种,已知A、B溶液中水的电离程度相同,A、C溶液的pH相同,则下列说法正确的是( )
| A、A、B、C、D四种溶液中水的电离程度:A=B<C<D |
| B、C溶液中存在如下等量关系:c(Na+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| C、C溶液中加水稀释后恢复至原温度,pH和Kw均减小 |
| D、A、B等体积混合后,溶液中各离子浓度由大到小的顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
实验室制氯气时,多余氯气用氢氧化钠溶液吸收,关于该反应的下列说法正确的是( )
| A、Cl2仅作氧化剂 |
| B、NaClO是还原产物 |
| C、每生成1mol NaCl,有1mol Cl2被氧化 |
| D、每转移1mol电子,有0.5mol Cl2被还原 |
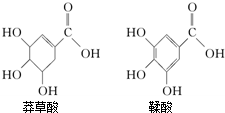 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )| A、两种酸都能与溴水发生反应 |
| B、鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| C、1mol莽草酸完全燃烧消耗7mol O2 |
| D、等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的量相同 |
下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C-H键:413.4kJ/mol、H-H键:436.0kJ/mol.则下列叙述正确的是( )
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
| A、C≡C键能为796.0 kJ/mol | ||
| B、2CH4(g)+2O2(g)═2H2O(l)△H=-890.3 kJ/mol | ||
C、H2(g)+
| ||
| D、2CH4(g)═C2H2(g)+3H2(g)△H=-376.4 kJ/mol |
某未知溶液中已检验出含大量的Fe2+、SO42-,且pH=1.欲检验此溶液中是否大量存在以下离子:①NH4+、②SiO32-、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
| A、①③⑤ | B、②⑤⑥ |
| C、①②⑥ | D、③④⑥ |
(CH3)2CHCH2OH是某有机物的加氢还原产物,该有机物可能是( )
| A、正丁醛的同分异构体 |
| B、正丁醛的同系物 |
| C、CH3CH2COCH3(2-丁酮) |
| D、CH2=C(CH3)CHO |
以下用于研究有机物的方法错误的是( )
| A、蒸馏常用于分离提纯液态有机混合物 |
| B、燃烧法是研究确定有机物成分的有效方法 |
| C、核磁共振氢谱通常用于分析有机物的相对分子质量 |
| D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |