题目内容
15.下列叙述正确的是( )| A. | 氧气的摩尔质量为32g | B. | NA个 O2分子的总质量为32g/mol | ||
| C. | 16g O2 的体积为11.2L | D. | 32g O2 的物质的量为1mol |
分析 A、摩尔质量的单位是g/mol;
B、根据m=mM=M来计算即可;
C、根据体积V=nVm结合标况下Vm的取值来计算;
D、根据m=nM来计算.
解答 解:A、摩尔质量的单位是g/mol,氧气的摩尔质量为32g/mol,故A错误;
B、根据m=mM=M,NA个O2分子的总质量为32g,单位错误,故B错误;
C、根据体积V=nVm,16g O2在标况下的体积为11.2L,故C错误;
D、根据m=nM,32g O2 的物质的量为=1mol,故D正确.
故选D.
点评 本题考查学生利用质量、摩尔质量、微粒数目、气体摩尔体积、物质的量的关系来解答,习题难度不大.

练习册系列答案
相关题目
5.有关金属晶体的下列说法正确的是( )
| A. | 金属晶体能导电,所以离子晶体也能导电 | |
| B. | 六方最密堆积和面心立方最密堆积中由于配位数都是12,所以所得晶胞的形式相同 | |
| C. | 金属晶体中金属原子的堆积模式有4种 | |
| D. | 金属晶体的电子气理论不能解释金属的延展性,但可以解释金属的导电性和熔点高低 |
6.根据热化学方程式:S(g)+O2(g)=SO2(g);△H=-a kJ•mol-1(a>0).下列说法正确的是( )
| A. | 1 mol SO2的总能量大于1 mol S和1 mol O2能量总和 | |
| B. | 1 mol SO2的总能量小于1 mol S和1 mol O2能量总和 | |
| C. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b小于a | |
| D. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b大于a |
3.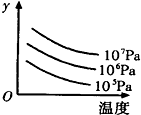 有某可逆反应aA(g)+bB(g)?cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)?cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
 有某可逆反应aA(g)+bB(g)?cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)?cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )| A. | a+b<c时,y轴表示平衡混合气中C的质量分数 | |
| B. | a+b<c时,y轴表示平衡混合气的平均摩尔质量 | |
| C. | △H>0时,y轴表示达到平衡时B的转化率 | |
| D. | △H>0时,y轴表示达到平衡时A的浓度 |
20.下列混合物的分离或提纯的方法不正确的是( )
| A. | 食用花生油中混有水:分液 | |
| B. | 回收碘的CCl4溶液中的CCl4:蒸馏 | |
| C. | 提纯含NaCl杂质的淀粉胶体:过滤 | |
| D. | 从氯化钠溶液中分离出NaCl晶体:蒸发 |
7.下列关于氧化还原反应说法正确的是( )
| A. | 一种元素被氧化,肯定有另外一种元素被还原 | |
| B. | 金属单质只有还原性,非金属单质只有氧化性 | |
| C. | 元素原子失电子数越多还原性越强,得电子数越多氧化性越强 | |
| D. | 有单质参加的化合反应和有单质生成的分解反应一定是氧化还原反应 |
4.在溶液导电性实验装置里,分别注入同体积同浓度的醋酸与氨水,灯光明暗程度相似.如果把这两种溶液混合后再实验,则( )
| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光变亮 | D. | 无法判断 |
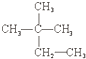 ③
③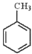 ④
④
 ⑧石墨 ⑨C2H4
⑧石墨 ⑨C2H4