题目内容
【题目】用如下图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0ml0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下

时间/s | 0 | t | 2t | ...... |
活塞的位置/ml | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是。
(2)仪器A的名称是。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是,原因是。
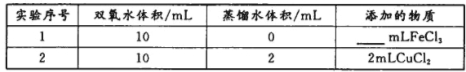
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:___________。
②上表中需要添加的物质是mlFeCl3溶液。
③本实验需要测定的数据是。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
MnO2 时间 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 36s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_________________________。(提示:H2O2溶液的密度可认为近似相等。)
【答案】(1)将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好。其他合理方案也可。
(2)分液漏斗
(3)t-2t镁与硫酸反应放热,温度升高,反应速率加快
(4)①
②4
③收集相同体积的氧气所需时间(或相同时间产生氧气的体积)
(5)①加快
②0.3
③不正确H2O2的浓度扩大2倍(从1.5%-3.0%),但反应所需时间比其2倍小得多
【解析】
试题分析:(1)检查该装置气密性的方法是将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;
(2)装置中仪器A的名称是分液漏斗;
(3)0-t时间段活塞移动8.3mL,t-2t时间段活塞移动11.0mL,化学反应速率最快的是t-2t时间段,原因是镁与硫酸反应放热,温度升高,反应速率加快;
(4)①H2O2分解反应方程式及电子转移的方向和数目为 ;
;
②为保证溶液的总体积相等,上表中需要添加的FeCl3溶液的体积为10+2+2-10=4ml;
③实验过程中可以通过测定收集相同体积的氧气所需时间(或相同时间产生氧气的体积)
来判断反应的速率大小;
(5)①浓度相等时,增加MnO2用量反应所需要的时间减小,说明反应速率随着MnO2用量的增加而加快;
②过多增加MnO2用量,速率并不完全成正比,则从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入0.3g的MnO2为较佳选择。
③不正确,理由是H2O2的浓度扩大2倍(从1.5%-3.0%),但反应所需时间比其2倍小得多。