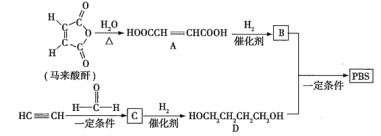
题目内容
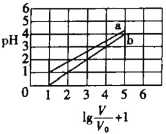
【题目】次磷酸(H3PO2一元弱酸)和氟硼酸(HBF4)均可用于植物杀菌。常温时,有1molL-1的H3PO2溶液和1molL-1的HBF4溶液,两者起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积均为V,两溶液的pH变化曲线如图所示。下列说法错误的是
A.常温下,NaBF4溶液的pH=7
B.常温下,H3PO2的电离平衡常数约为1.1![]() 10-2
10-2
C.NaH2PO2 溶液中:c(Na+) =c( H2PO2- ) +c( HPO22-) +c(PO23-) +c( H3PO2)
D.常温下,在0≤pH≤4时,HBF4溶液满足![]()
【答案】C
【解析】
此题的横坐标是![]() ,V是加水稀释后酸溶液的体积,未稀释时,V=V0,横坐标值为1;稀释10倍时,V=10V0,横坐标值为2,以此类推。此题实际上考察的是稀释过程中,酸碱溶液pH的变化规律:越强的酸碱,稀释过程中pH的变化越明显;如果不考虑无限稀释的情况,对于强酸或强碱,每稀释十倍,pH变化1。根据此规律,再结合题干指出的次磷酸是弱酸这条信息,就可以明确图像中两条曲线的归属,并且可以得出氟硼酸是强酸这一信息。
,V是加水稀释后酸溶液的体积,未稀释时,V=V0,横坐标值为1;稀释10倍时,V=10V0,横坐标值为2,以此类推。此题实际上考察的是稀释过程中,酸碱溶液pH的变化规律:越强的酸碱,稀释过程中pH的变化越明显;如果不考虑无限稀释的情况,对于强酸或强碱,每稀释十倍,pH变化1。根据此规律,再结合题干指出的次磷酸是弱酸这条信息,就可以明确图像中两条曲线的归属,并且可以得出氟硼酸是强酸这一信息。
A.根据图像可知,b表示的酸每稀释十倍,pH值增加1,所以b为强酸的稀释曲线,又因为H3PO2为一元弱酸,所以b对应的酸只能是氟硼酸(HBF4),即氟硼酸为强酸;那么NaBF4即为强酸强碱盐,故溶液为中性,常温下pH=7,A项正确;
B.a曲线表示的是次磷酸的稀释曲线,由曲线上的点的坐标可知,1mol/L的次磷酸溶液的pH=1,即c(H+)=0.1mol/L;次磷酸电离方程式为:![]() ,所以1mol/L的次磷酸溶液中c(H3PO2)=0.9mol/L,c(
,所以1mol/L的次磷酸溶液中c(H3PO2)=0.9mol/L,c(![]() )=0.1mol/L,那么次磷酸的电离平衡常数即为:
)=0.1mol/L,那么次磷酸的电离平衡常数即为:![]() ,B项正确;
,B项正确;
C.次磷酸为一元弱酸,![]() 无法继续电离,溶液中并不含有
无法继续电离,溶液中并不含有![]() 和
和![]() 两类离子;此外,
两类离子;此外,![]() 还会发生水解产生次磷酸分子,所以上述等式错误,C项错误;
还会发生水解产生次磷酸分子,所以上述等式错误,C项错误;
D.令y=pH,x=![]() ,由图可知,在0≤pH≤4区间内,y=x-1,代入可得pH=
,由图可知,在0≤pH≤4区间内,y=x-1,代入可得pH=![]() ,D项正确;
,D项正确;
答案选C。

 名校课堂系列答案
名校课堂系列答案