��Ŀ����
����Ŀ����.ijǿ������Һ X �к��� Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32-��SO32-��SO42-��Cl-�� NO3-�е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ��������£�

����������Ϣ���ش��������⣺
(1) ���������У�����ȷ���Ƿ��е�������_______________����Ҫ��ʵ��֤��������һ�������ڣ���ɿ��Ļ�ѧ������______________________��
(2)д�����з�Ӧ�Ĺ����ӷ���ʽ��
������������A��_______________________��
�����ɳ���I��____________________________��
(3)����ⶨA��F��I��Ϊ0.01mol��10mLX��Һ��n(H+)=0.04mol���Ҳ���ȷ�����е�����ֻ��һ�֣���X��Һ�в���ȷ����������__________������C�����ʵ���Ϊ______________��
��.��ͭ�����Ҫ�ɷ���Cu2S���ӻ�ͭ���н�ȡͭԪ�أ�����FeCl3����ȡ����
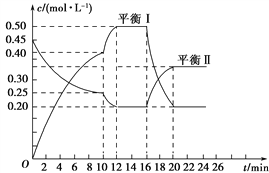
(1)��ȡʱ�ķ�ӦΪ��Cu2S+4FeCl3=2CuCl2+4FeCl2+S����ȡ�����м���ϴ�Ӽ��ܽ���ʱ��ͭԪ�صĽ�ȡ�ʵı仯��ͼ����ԭ����_________________��

353Kʱ����FeCl3��ȡҺ������CuCl2���ܼӿ�ͭԪ�صĽ�ȡ���ʣ��䷴Ӧԭ�����û�ѧ����ʽ��ʾΪ_______________�� CuCl+FeCl3=CuCl2+FeCl2��
(2)CuSO4��5H2O��Ʒ������ˮ���̵���������(��Ʒ�������¶ȱ仯������)��ͼ��ʾ����ȷ��200��ʱ�������ʵĻ�ѧʽΪ__________________��

���𰸡� Fe3+ ȡ����X��Һ�����Թ��У����뼸��KSCN��Һ����Һ�����ɫ˵����Fe3+������������Ҳ�ɣ��� 3Fe2++4H++NO3-��3Fe3++NO��+2H2O AlO2��+CO2+2H2O��Al(OH)3��+HCO3�� Fe3+����Cl���� ��0.07mol����0.07mol�� ���ɵ�����Cu2S���棬�谭��ȡ Cu2S+2CuC12=4CuC1+S CuSO4��H2O
��������ǿ������Һ��һ���������CO32-��SO32-���ӣ�����������ᱵ���ɳ�������ó���ΪBaSO4������˵����Һ�к���SO42-���ӣ���������A��A��������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ�һ��ΪFe2+���ӣ���ҺB�м������NaOH��Һ������GΪFe��OH��3����������F����FΪNH3��˵����Һ�к���NH4+���ӣ���ҺH��ͨ��CO2���壬���ɳ���I����IΪAl��OH��3��HΪNaOH��NaAlO2��˵����Һ�к���Al3+���ӣ���Һ�к���Fe2+���ӣ���һ������NO3-���ӣ�����SO42-���Ӿ�һ������Ba2+���ӣ�����ȷ���Ƿ��е�����Fe3+��Cl-����1���������Ϸ�����֪����Һ�в���ȷ����������ΪFe3+��ͨ�������軯����Һ���������ӣ����鷽��Ϊ��ȡ����X��Һ�����Թ��У����뼸��KSCN����Һ�����ɫ˵����Fe3+���ʴ�Ϊ��Fe3+��ȡ����X��Һ�����Թ��У����뼸��KSCN����Һ�����ɫ˵����Fe3+����2��������AΪNO��Fe2+���ӱ�����ΪFe3+���ӣ�NO3-���ӱ���ԭΪNO���壬��Ӧ�����ӷ���ʽΪ��3Fe2++NO3-+4H+=3Fe3++NO��+2H2O����H��NaAlO2������IΪ����������ƫ����������������̼��Ӧ������������������Ӧ�����ӷ���ʽΪ��AlO2-+CO2+2H2O=Al��OH��3��+HCO3-����3��A��F��I��Ϊ0.01mol��10mLX��Һ��n��H+��=0.04mol�����ݷ�Ӧ3Fe2++NO3-+4H+=3Fe3++NO��+2H2O����֪��������Ϊ0.03mol��������Һ�����Կ�֪��2n��Fe2+��+3n��Al3+��+n��NH4+��=2n��SO42-����n��SO42-��=
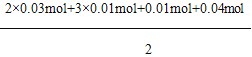 =0.07mol����X��Һ�в���ȷ����������Fe3+������������ӵ����ʵ�������0.07mol�����ɳ���C���ᱵ�����ʵ�������0.07mol����X��Һ�в���ȷ��������ΪCl-������������ӵ����ʵ���С��0.07mol�����ɳ���C���ᱵ�����ʵ���С��0.07mol��
=0.07mol����X��Һ�в���ȷ����������Fe3+������������ӵ����ʵ�������0.07mol�����ɳ���C���ᱵ�����ʵ�������0.07mol����X��Һ�в���ȷ��������ΪCl-������������ӵ����ʵ���С��0.07mol�����ɳ���C���ᱵ�����ʵ���С��0.07mol��
II����1��Cu2S���ܣ����ɵ�����Cu2S���棬�谭��ȡ������ϴ��ʱͭԪ�صĽ�ȡ�ʵı仯��ͼ����ȡʱ���ܷ�ӦΪ��Cu2S+4FeCl3=2CuCl2+4FeCl2+S����FeCl3��ȡҺ������CuCl2���ܼӿ�ͭԪ�صĽ�ȡ���ʣ��������������Ӧ CuCl+FeCl3=CuCl2+FeCl2�����ܷ�Ӧ��ȥ�����Ӧ��Ϊ��Cu2S+2CuC12=4CuC1+S����2��CuSO45H2O���ȵ�102��ʱ��ʼ��ˮ�ֽ⣬113��ʱ�ɵõ����ȶ���һ���м����258��ʱ�Ż�����ֽ⣮��200��ʱʧȥ��ˮ������Ϊ0.80g-0.57g=0.23g�����ݷ�Ӧ�Ļ�ѧ����ʽ��CuSO45H2O== CuSO4��5-n��H2O+nH2O
250 18n
80g 80g-57g=23g
���n=4�����ԣ�200��ʱ�ù������ʵĻ�ѧʽΪCuSO4H2O��

 ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�