题目内容
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
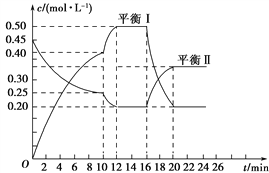
(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
【答案】 0.02mol/L 1:2 变大 ④⑥ ④ >
【解析】试题分析:(1)0~10min内容器中A的物质的量浓度变化为:0.45mol/L-0.25mol/L=0.2mol/L;0~10min内容器中C的物质的量浓度变化为:0.40mol/L,x:y=0.2mol/L:0.40mol/L=1:2。
(2)0~10min内△n(A)=0.45mol-0.25mol=0.2mol,v(A)=△c/△t=[(0.450.25)mol/L]÷10min=0.02mol·(L·min)-1。
(3)反应前气体物质的量小于反应后气体物质的量,随着反应的进行,气体物质的量增大,气体压强增大。
(4)第10min时,单位时间内A、C的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂;第16min时,C的物质的量减小,A的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度。
(5)已知第16min时改变的条件是升高温度,而该反应是放热反应,所以升高温度平衡逆移,则平衡常数减小,所以K1>K2。

 寒假学与练系列答案
寒假学与练系列答案



