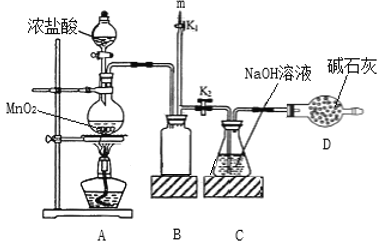
题目内容
【题目】现有常温下的六种溶液:①0.01mol·L-1CH3COOH溶液;②0.01mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)将②③混合后所得溶液pH=7,则消耗溶液的体积:②__(填“>”“<”或“=”)③。
(2)若将②③等体积混合后,则所得混合溶液中各离子浓度大小顺序为__。
(3)将六种溶液稀释100倍后,比较溶液的pH:③__(填“>”“<”或“=”)④。
(4)水的电离程度相同的是__(填序号)。
(5)将①④混合,若有c(CH3COO-)>c(Na+),则混合液呈_(填字母)。
A.酸性 B.碱性 C.中性 D.三性皆有可能
(6)若改变温度后,测得④溶液pH=10,则该温度下Kw=__。在该温度下,将①④混合后,测得溶液pH=7,则所得溶液中c(Na+)-c(CH3COO-)=__mol·L-1。
【答案】> c(NH4+)>c(Cl-)>c(OH-)>c(H+) > ②③④ A 10-12 (10-5-10-7)或9.9×10-6
【解析】
(1)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液显碱性,据此分析判断;
(2)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液呈碱性,据此分析排序;
(3)加水稀释促进弱电解质的电离,③④中氢氧根离子浓度相等,加水稀释促进一水合氨电离,导致③中氢氧根离子浓度大于④,据此判断;
(4)酸或碱抑制水的电离,含有弱根离子的盐促进水的电离,①②③④⑤抑制水的电离,⑥既不促进水的电离也不抑制水的电离;酸中氢离子浓度和碱中氢氧根离子浓度相等时,水的电离程度相同,据此分析判断;
(5)将①、④混合,若有c(CH3COO-)>c(Na+),根据电荷守恒分析判断;
(6)常温下,④pH=12的NaOH溶液,c(OH-)=10-2mol/L,改变温度后,pH=10,c(H+)=10-10,结合Kw=c(OH-)c(H+)计算;在该温度下,pH=7,溶液显碱性,根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则所得溶液中c(Na+)-c(CH3COO-)=c(OH-)-c(H+)据此计算。
①0.01mol/LCH3COOH溶液中pH大于2;
②0.01mol/LHCl溶液中pH=2;
③pH=12的氨水中氨水浓度大于0.01mol/L;
④pH=12的NaOH溶液中氢氧化钠浓度等于0.01mol/L;
⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液,氨水过量,溶液呈碱性;
⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液,二者恰好反应生成氯化钠,溶液呈中性。
(1)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液显碱性,要使pH=7,则消耗的盐酸的体积较大,故答案为:>;
(2)②0.01mol/LHCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol/L,等体积混合,氨水过量,氨水继续电离,溶液呈碱性,所得混合溶液中各离子浓度大小顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(3)将这几种溶液稀释100倍数时,加水稀释促进弱电解质的电离,③④中氢氧根离子浓度相等,加水稀释促进一水合氨电离,导致③中氢氧根离子浓度大于④,所以③的pH>④的pH,故答案为:>;
(4)酸或碱抑制水的电离,含有弱根离子的盐促进水的电离,①②③④⑤抑制水的电离,⑥既不促进水的电离也不抑制水的电离,所以水的电离程度最大的是⑥;酸中氢离子浓度和碱中氢氧根离子浓度相等时,水的电离程度相同,②的氢离子浓度和③④中氢氧根离子浓度相等,所以水的电离程度相同的是②③④,故答案为:②③④;
(5)将①、④混合,若有c(CH3COO-)>c(Na+),根据电荷守恒,则有c(OH-)<c(H+),混合溶液呈酸性,故答案为:A;
(6)常温下,④pH=12的NaOH溶液,c(OH-)=10-2mol/L,改变温度后,pH=10,则Kw=c(OH-)c(H+)=10-2×10-10=10-12;在该温度下,pH=7,溶液显碱性,根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则所得溶液中c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=![]() -10-7=10-5-10-7,故答案为:10-12;10-5-10-7。
-10-7=10-5-10-7,故答案为:10-12;10-5-10-7。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案