��Ŀ����
����Ŀ����1����һ��ȼ�ϵ�أ�����ȼ��ΪH2�Ϳ����������Ϊ���ڵ�K2CO3���ش���������
��CO![]() ����____________����
����____________����
��������ӦʽΪ____________________��
�۵����CO![]() �����ʵ�������________________���������١����䣩��
�����ʵ�������________________���������١����䣩��
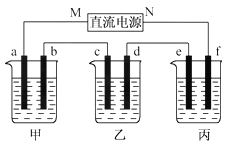
��2��������ĵ�ض������ʽ��е�⣬����a��b��c��d��e��f�缫��Ϊ���Ե缫��ͨ���a���������������Զ���b����2���Ӻ���ҳص�pHΪ12����
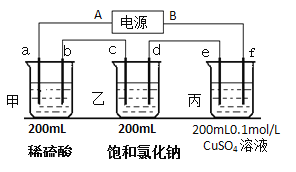
�ٵ�ԴA����______________����
��c���ϵĵ缫��Ӧʽ��___________________��
�ۼס������ع����ռ���________mol���塣
�ܱ�װ����ij������������________�ˣ���Һ��pHΪ________________�������£���������Һ����仯��
�ݵ��n���Ӻ�����ͭ���������꣬�ٽ�e��f�缫���ӵ�Դ����ͬ���ĵ����ٵ��n���ӣ������Һ�е�����ͭ�����ʵ���Ũ��Ϊ______________mol/L������������Һ����仯��
���𰸡���O2 +2CO2+4e- =2CO���������为2H++2e-= H 2��дˮ�ŵ�Ҳ����3.5��10����0.06420.1
�����������⿼��绯ѧ֪ʶ��Ӧ��ԭ��صĹ���ԭ���͵��ԭ����֪ʶ���֣���1��������ԭ��ص�ԭ�������������ƶ����������������ƶ������CO32�����ƶ�����ͨ����һ��Ϊ������ͨȼ�ϵ�һ��Ϊ�����������Ϊ����״̬��K2CO3�����������Ӧ������ת����CO32�����缫��ӦʽΪO2��2CO2��4e��=2CO32������������ӦʽΪH2��2e����CO32��=H2O��CO2���ܵ缫��ӦʽΪ2H2��O2=2H2O�����CO32�������ʵ������䣻��2�����������õ��ԭ�������жϣ��׳���������Ӧʽ��2H����2e��=H2����������ӦʽΪ4OH����4e��=2H2O��O2����������·ͨ�����ӵ����ʵ�����ȣ��������������������������a������H2��b������O2�����ӵ�Դ�����ĵ缫Ϊ���������ӵ�Դ�����ĵ缫Ϊ���������AΪ������BΪ��������c��ӦΪ��������Һ����������Na����H����H���ķŵ�˳�����Na�����缫��ӦʽΪ2H����2e��=H2�������ҳ���Һ��pH=12���Ƴ�c(OH��)=Kw/c(H��)=10��14/10��12mol��L��1=10��2mol��L��1��OH��Ӧ�������ϲ�������缫��ӦʽΪ2H2O��2e��=H2����2OH�������������·��ͨ���������ʵ���Ϊ200��10��3��10��2mol=2��10��3mol���������������ʵ���Ϊ2��10��3/2mol=1��10��3mol��������ӦʽΪ2Cl����2e��=Cl2�������������ʵ���Ϊ��2��10��3/2mol=1��10��3mol���������м׳ص缫��Ӧʽ������׳��в���H2�����ʵ���Ϊ2��10��3/2mol=1��10��3mol���������������ʵ���Ϊ2��10��3/4mol=5��10��4mol�����������ʵ���Ϊ��(1��10��3��1��10��3��1��10��3��5��10��4)mol=3.5��10��3mol������װ�ã�e�缫Ϊ�����������缫��ӦʽΪCu2����2e��=Cu����˲���ͭ������Ϊ2��10��3��64/2g=0.064g��������ӦʽΪ��2H2O��4e��=O2����4H����n(H��)=2��10��3mol��c(H��)=2��10��3/200��10��3mol��L��1=0.01mol��L��1����pH=2�����ӷ�ʱ��eΪ������fΪ���������e����ӦʽCu��2e��=Cu2����f�缫��ӦʽΪ��2H����2e��=H2����ͨ����ʱ����ͬ�����ͭȫ��ʧȥ���ӣ���Ϊ��������Һ����仯���������ͭ��Ũ�ȱ��ֲ��䣬��Ϊ0.1mol��L��1��

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�����Ŀ���������е����Ų�ʽ��ԭ���У��뾶������
A. 1s22s22p63s23p4 B. 1s22s22p3
C. 1s22s22p2 D. ls22s22p63s23p1
����Ŀ����1��ij����С���о��������������������£��ı���ʼ�������ʵ�������n��H2����ʾ����N2(g)��3H2(g) ![]() 2NH3(g) ��H < 0��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ������ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
2NH3(g) ��H < 0��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ������ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
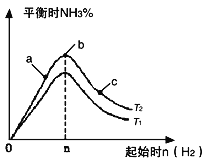
�� �Ƚ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ���_____________��
�� �������ݻ�Ϊ1L��n��3mol����Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%��H2�� N2���ʵ���֮��Ϊ3��1��������ʼʱ��ϵ�м���N2�����ʵ���Ϊ___________mol���������£�T2������Ӧ��ƽ�ⳣ��K �� ______________��
�� ͼ����T2��T1�Ĺ�ϵ��T2_____________ T1������ڡ��������ڡ��������ڡ�������ȷ��������
��2��N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2 N2O5 (g)4NO2(g)+O2(g)��H��0T1�¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
ʱ��/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/molL-1 | 5.00 | 3.52 | 2.50 | 2.50 |
�ٴ�ƽ��������������䣬�����������ѹ����ԭ����![]() ����c��N2O5��_______������ڡ�����С�ڡ��������ڡ�������ȷ������5.00molL-1
����c��N2O5��_______������ڡ�����С�ڡ��������ڡ�������ȷ������5.00molL-1
��500s��N2O5�ֽ�����Ϊ ____________��
��T1�¶��� ƽ��ʱN2O5��ת����Ϊ____________��
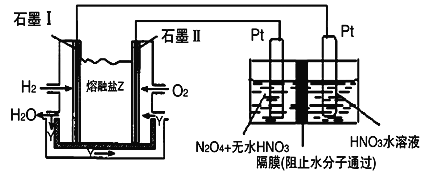
��3������H2��O2��������Na2CO3��ɵ�ȼ�ϵ�أ���ͼ��ʾ������YΪCO2��װ�ý��е�⡣
д��ʯīII�缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ__________________ ��
�ڵ���������N2O5�ĵ缫��ӦʽΪ__________________ ��