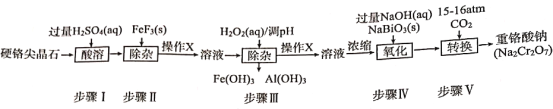
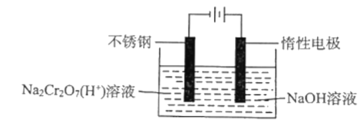
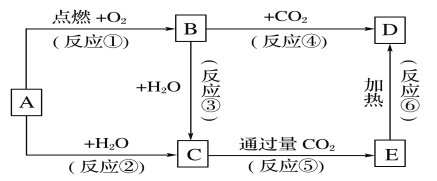
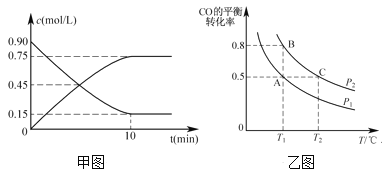
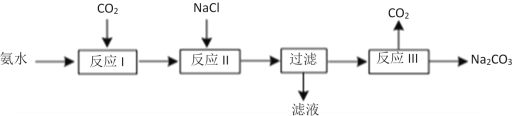
题目内容
【题目】某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
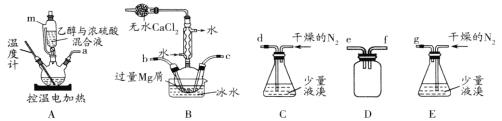
已知:①乙醚的熔点为-116.3℃,沸点为34.6℃。
②Mg和Br2反应非常剧烈,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
③不考虑氮气与镁的反应
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,使溴分子缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤,将滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
请回答下列问题:
(1)装置A中使用仪器m的优点是_______;
(2)步骤I中所选装置的正确连接顺序是a _____(填小写字母),装置D的作用是____;
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________;
(4)实验中不能用干燥空气代替干燥N2,原因是___________;
(5)有关步骤V的说法,正确的是____;
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+-络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式为:Mg2+ + Y4-=MgY2-,Mg2+-络黑T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为____________________;
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0.0500 mol·L-1 EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00 mL,则测得无水MgBr2产品的纯度是___(以质量分数表示)。
【答案】使系统内压强相等,便于液体顺利流下 efbcg(ef可颠倒,bc可颠倒) 防止倒吸 停止加热,冷却后补加碎瓷片 防止镁屑与氧气反应生成的MgO阻碍Mg和Br2的反应 BD 当滴加最后一滴EDTA标准溶液时,溶液由酒红色变为蓝色,且半分钟内溶液颜色保持不变 92%
【解析】
根据实验步骤,首先需要利用装置A制取乙醚,反应温度为140℃,乙醚会成为气体,将乙醚通入装置B中进行反应,镁和溴反应剧烈,可以在A和B之间连接D装置作为安全瓶,防止倒吸;之后需要通入干燥的氮气将溴吹入B装置进行反应,为控制反应剧烈程度,可选用E装置来通氮气,据此分析解答。
(1)仪器m为恒压滴液漏斗,可以使系统内压强相等,便于液体顺利流下;
(2)根据分析可知装置A中生成乙醚后,需要先连接安全瓶,e进气或f进气均可,之后需要连接B装置,在装置内进行反应,b进或c进均可,之后连接E装置,所以连接顺序为efbcg(ef可颠倒,bc可颠倒);D装置作为安全瓶,防止倒吸;
(3)若忘记加入碎瓷片,需停止加热,冷却后补加碎瓷片;
(4)空气中有氧气,镁屑与氧气反应生成的MgO会阻碍Mg和Br2的反应;
(5)A.已知:MgBr2具有强吸水性,95%的乙醇中有水,不能用95%的乙醇代替,故A错误;
B.为降低产品的溶解损耗,洗涤晶体可选用0℃的苯,故B正确;
C.加热至160℃的主要目的是分解乙醚合溴化镁得到溴化镁,故C错误;
D.溴化镁和乙醚的反应为可逆反应,完全反应后有剩余的乙醚和可能残留的溴,用苯可以洗去,故D正确;
综上所述选BD;
(6)①根据滴定原理,用EDTA(简写为Y4-)标准溶液滴定溴化镁,以铬黑T(简写为In)为指示剂,则指示剂与Mg2+形成酒红色MgIn-,当EDTA与Mg2+反应完全,溶液显示铬黑T的蓝色,故终点为:滴入最后一滴EDTA标准液时,溶液由酒红色变为蓝色,且半分钟内保持不变;
②依据方程式Mg2++Y4-=MgY2-,溴化镁的物质的量=0.0500mol/L×0.025L=0.00125mol,则溴化镁的质量为0.00125mol×184g/mol=0.23g,则无水MgBr2产品的纯度是![]() ×100%=92%。
×100%=92%。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】Ⅰ.下表是A、B两种有机物的有关信息:
A | B |
①分子填充模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2CH2
(2)A与氢气发生加成反应后生成物质C,与C在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类有机物开始出现同分异构体。
(3)B与乙醇反应的化学方程式为___,反应类型为____。
Ⅱ.糖类、油脂和蛋白质是人体需要的重要营养素。
(4)下列说法正确的是____(填标号)。
a.糖类、油脂、蛋白质都是仅由C、H、O三种元素组成的
b.糖类、油脂、蛋白质都是高分子化合物
c.油脂有油和脂肪之分,都属于酯
(5)淀粉和纤维素的化学式都是(C6H10O5)n,它们____(填“是”或“不是”)同分异构体,淀粉水解的最终产物是____(写名称)。
(6)重金属盐能使人体中毒,这是由于它使人体内的蛋白质发生了____(填“盐析”或“变性”)作用。
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。