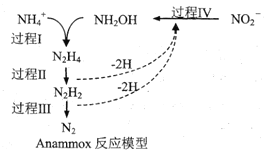
题目内容
【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
试写出由CH4和O2制取甲醇蒸气的热化学方程式:____。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=_______。
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=_______。
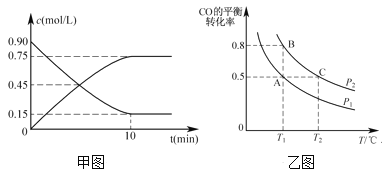
(3)在一容积可变的密闭容器中充入1 molCO和2mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是____。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为2L。如果反应开始时仍充入1molCO和2molH2,则在平衡状态B时容器的体积V(B)=___L。
【答案】2CH4(g) +O2(g)= 2CH3OH(g) ΔH=(a+b) kJ/mol 0.15molL-1min-1 BD < 0.4
【解析】
⑴已知2CH4(g) +O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
将两个方程式相加之和,得到2CH4(g) +O2(g)= 2CH3OH(g) ΔH=(a+b) kJ/mol,故答案为2CH4(g) +O2(g)= 2CH3OH(g) ΔH=(a+b) kJ/mol;
⑵甲图反应时CO物质的量浓度从0.90 mol/L变到0.15 mol/L,浓度改变量为0.75mol/L,H2浓度改变量为1.5 mol/L,H2的平均反应速率![]()
故答案为0.15molL-1min-1;
⑶①A选项,H2的消耗速率正向,CH3OH的生成速率正向,两个同方向,不能作为平衡的标志,故A错误;
B选项,H2的体积分数不再改变,能作为判断平衡的标志,故B正确;
C选项,体系中H2的转化率和CO的转化率始终相等,没有变化,因此不能作为判断平衡的标志,故C错误;
D选项,![]() ,气体质量不变,气体的物质的了减小,摩尔质量增大,能作为判断平衡的标志,故D正确;
,气体质量不变,气体的物质的了减小,摩尔质量增大,能作为判断平衡的标志,故D正确;
综上所述,答案为BD;
②从A到B,转化率变大,说明正向移动,正向为体积减小的反应,说明是加压,即PA小于PB,故答案为<;
③A、B两点温度相同,压强不同,要求B点的容器体积,则通过平衡常数不变来求,在A点:
CO(g)+ 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始量 1 mol 2 mol 0
转化量 0.5 mol 1 mol 0.5 mol
平衡量 0.5 mol 1 mol 0.5 mol
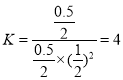
在B点,设体积为V L,
CO(g)+ 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始量 1 mol 2 mol 0
转化量 0.8 mol 1.6 mol 0.8 mol
平衡量 0.2 mol 0.4 mol 0.8 mol
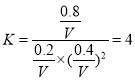
V= 0.4 L
故答案为0.4。