题目内容
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g) △H= -1077kJmol-1
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N | N≡N | O-H |
E/(kJmol-1) | 390 | 190 | 946 | 460 |
则使1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是___________。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
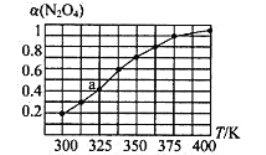
①由图推测该反应的△H ___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强po为108 kPa,则该温度下反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
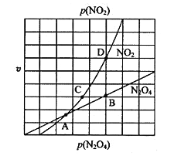
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。
(3)电解NO2制备NH4NO3,其工作原理如图所示。

①阳极的电极反应式为________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物A,则A的化学式为_________。
【答案】1941 kJ >温度升高,α(N2O4)增加,说明平衡右移。该反应为吸热反应,△H>0115.2KPa![]() B点与D点NO2-e-+H2O=NO3-+2H+NH3
B点与D点NO2-e-+H2O=NO3-+2H+NH3
【解析】
根据反应的焓变=反应物总键能-生成物总键能计算。根据图像分析,随着温度升高,四氧化二氮的平衡转化率增大,说明升高温度有利于反应正向进行,据此判断焓变。根据反应方程式计算平衡时体系中的四氧化二氮和二氧化氮的分压,代入平衡常数表达式计算分压平衡常数即可。电解池阳极发生氧化反应,根据原理分析,二氧化氮在阳极变为硝酸根离子,阴极为二氧化氮变为铵根离子,根据电子守恒分析硝酸根离子和铵根离子的物质的量的关系,并分析使二氧化氮电解全部转化为硝酸铵需要将剩余的氢离子转化为铵根离子,据此分析A物质。
(1) 假设1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量为xkJ,△H =2×(190+390×4)+x-946×3-460×8=-1077,计算x=1941 kJ; (2) ①根据图像分析,随着温度升高,α(N2O4)增加,说明平衡右移。该反应为吸热反应,△H>0 ;②四氧化二氮与二氧化氮之间存在反应,a点起始时四氧化二氮的压强为108kPa,四氧化二氮的平衡转化率为40%,则平衡时p(N2O4)=po (1-40%),p(NO2)= po ×40%×2,所以反应的分压平衡常数为![]() 115.2KPa; ③当达到平衡时满足正逆反应速率相等,即消耗速率2v( N2O4)= v(NO2),又有v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),则k1、k2与平衡常数Kp的关系为Kp=
115.2KPa; ③当达到平衡时满足正逆反应速率相等,即消耗速率2v( N2O4)= v(NO2),又有v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),则k1、k2与平衡常数Kp的关系为Kp= ![]() 。根据2v( N2O4)= v(NO2),则可以表示化学平衡的点为B点与D点。 (3) ①电解池阳极发生氧化反应,根据原理图分析,二氧化氮在阳极失去电子转化为硝酸根离子,则阳极的电极反应为 NO2-e-+H2O=NO3-+2H+;②阴极反应为二氧化氮变成铵根离子,电极反应为NO2+7e-+8H+ =NH4++2H2O,产生多余的氢离子,为了使二氧化氮电解全部转化为硝酸铵,则需要反应掉H+产生铵根离子,所以加入的A物质为NH3。
。根据2v( N2O4)= v(NO2),则可以表示化学平衡的点为B点与D点。 (3) ①电解池阳极发生氧化反应,根据原理图分析,二氧化氮在阳极失去电子转化为硝酸根离子,则阳极的电极反应为 NO2-e-+H2O=NO3-+2H+;②阴极反应为二氧化氮变成铵根离子,电极反应为NO2+7e-+8H+ =NH4++2H2O,产生多余的氢离子,为了使二氧化氮电解全部转化为硝酸铵,则需要反应掉H+产生铵根离子,所以加入的A物质为NH3。