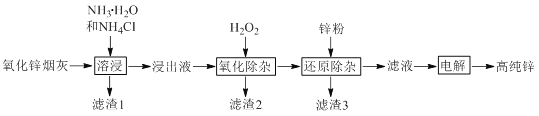
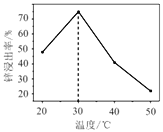
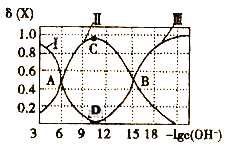
题目内容
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I- 的溶液中,H2O2分解的机理为①H2O2+I-→H2O+IO-(慢)、② H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )
A.过氧化氢分解快慢决定于反应慢的①
B.![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C.该反应的催化剂是![]() ,而不是
,而不是![]()
D.由于催化剂的加入降低了反应的活化能,也改变了该反应的反应热
【答案】D
【解析】
A. 已知:①H2O2+I-→H2O+IO-,②H2O2+IO-→H2O+O2+I-,I- 是反应的催化剂,且为①的反应物之一,其浓度大小对反应有影响,化学反应速率的快慢由反应慢的反应决定,故A正确;
B. ②H2O2+IO-→H2O+O2+I- ,过氧化氢分解快慢决定于反应慢的①,![]() 的分解速率与
的分解速率与![]() 浓度有关,故B正确;
浓度有关,故B正确;
C. 已知:①H2O2+I-→H2O+IO-,②H2O2+IO-→H2O+O2+I-,I- 是反应的催化剂,IO-为催化剂的中间产物,故C正确;
D. 催化剂能降低反应的活化能,但不改变反应热,故D错误;
题目要求选择错误选项,故选D。

练习册系列答案
相关题目
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号,其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.R原子的核外电子排布图为![]()
B.Y2-与Na+的半径大小关系为Y2->Na+
C.X的第一电离能小于Y的第一电离能
D.表中电负性最大的元素为W