题目内容
9.设NA为阿伏加德罗常数,下列叙述中正确的是( )| A. | 12.4g白磷晶体中含有的P-P键数是0.4NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 2 mol SO2和1 molO2在一定条件下的密闭容器中反应,反应后分子总数大于2 NA | |
| D. | 1mol甲醇中含有C-H键的数目为4NA |
分析 A.白磷为正四面体结构,1mol白磷含有6molP-P键,据此计算P-P键的物质的量,再根据N=nNA计算P-P键数目;
B.Na2S和Na2O2的摩尔质量都是78g/mol,根据n=mM计算混合物的物质的量,1molNa2S、1molNa2O2都含有1mol阴离子,据此计算;
C.二氧化硫与氧气反应生成三氧化硫,属于可逆反应,平衡后容器内气体分子数目大于2mol;
D.甲醇为CH3OH,1个分子甲醇中含有3个C-H键.
解答 解:A.白磷分子的物质的量为12.4g124g/mol=0.1mol,白磷为正四面体结构,1mol白磷含有6molP-P键,故12.4g比例含有P-P键的物质的量0.6mol,P-P键数目为0.6NA,故A错误;
B.Na2S和Na2O2的摩尔质量都是78g/mol,平均摩尔质量为78g/mol,混合物的物质的量为:7.8g78g/mol=0.1mol,1molNa2S、1molNa2O2都含有1mol阴离子,故7.8g Na2S和Na2O2的混合物中含有的阴离子数为0.1NA,故B错误;
C.二氧化硫与氧气反应生成三氧化硫,属于可逆反应,平衡后容器内气体分子数目大于2mol,故容器内物质分子数大于2NA,故C正确;
D.甲醇的结构简式为CH3OH,其分子中含有3个碳氢键,则1mol甲醇中含有C-H键的数目为3NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B中注意过氧化钠中阴离子为过氧根离子.

练习册系列答案
相关题目
17.下列各组离子,在溶液中能大量共存的是( )
| A. | Na+、H+、I-、SO4- | B. | Ba2+、K+、CO32-、Cl- | ||
| C. | S2-、Cl-、Na+、H+ | D. | Ca2+、Fe3+、NO3-、SCN- |
4.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 |
14.以下对核外电子运动状况的描述正确的是( )
| A. | 同一原子中,2p,3p,4p能级的轨道依次增多 | |
| B. | 当碳原子的核外电子排布由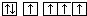 转变为 转变为 这一过程释放能量 这一过程释放能量 | |
| C. | 3p2表示3p能级有两个轨道 | |
| D. | 在同一能级上运动的电子,其运动状态可能相同 |
1.盆烯的分子结构如图所示(其中碳、氢原子均已略去).关于盆烯的说法正确的是( )
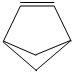

| A. | 盆烯的一氯取代物有5种 | B. | 盆烯能与氢气发生加成反应 | ||
| C. | 盆烯是苯的一种同分异构体 | D. | 盆烯是乙烯的一种同系物 |
19.下列化学用语表达正确的是( )
| A. | 羟基的电子式: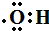 | B. | 聚丙烯结构简式: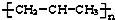 | ||
| C. | CO2的比例模型: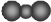 | D. | 乙烯的结构简式:CH2CH2 |