题目内容
19.A、B、C、D四种元素,A为地壳这含量最多的元素;B的单质在气体中密度最小;C元素的原子失去两个电子后,其电子层结构和氩原子相同;D元素的原子核外有三个能层,各能层电子数之比为1:4:1.(1)上述四种元素的化学式:AO、BH、CCa、DMg.
(2)写出C2+离子的电子排布式1s22s22p63s23p6
(3)A、B、C三种元素所形成的化合物中所包含的所有化学键的类型离子键、共价键.
分析 A、B、C、D四种元素,A为地壳这含量最多的元素,则A为O元素;B的单质在气体中密度最小,则B为H元素;C元素的原子失去两个电子后,其电子层结构和氩原子相同,则C为Ca;D元素的原子核外有三个能层,各能层电子数之比为1:4:1,即各层电子层分别为2、8、2,故D为Mg,据此解答.
解答 解:(1)A、B、C、D四种元素,A为地壳这含量最多的元素,则A为O元素;B的单质在气体中密度最小,则B为H元素;C元素的原子失去两个电子后,其电子层结构和氩原子相同,则C为Ca;D元素的原子核外有三个能层,各能层电子数之比为1:4:1,即各层电子层分别为2、8、2,故D为Mg,
故答案为:O;H;Ca;Mg;
(2)Ca2+离子的电子排布式:1s22s22p63s23p6,故答案为:1s22s22p63s23p6;
(3)A、B、C三种元素所形成的化合物为氢氧化钙,含有离子键、共价键,故答案为:离子键、共价键.
点评 本题考查结构性质位置关系应用,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
10.在2A+B═3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是( )
| A. | vA=0.5mol•L-1•min-1 | B. | vB=0.3mol•L-1•min-1 | ||
| C. | vC=0.8mol•L-1•min-1 | D. | vD=1mol•L-1•min-1 |
7.下列电极反应正确的是( )
| A. | 用惰性电极电解饱和食盐水阳极反应式:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| D. | 铅蓄电池放电时的负极反应式为:Pb+SO42--2e-═PbSO4 |
14.下列物质中既有配位键,又有离子键,还有共价键的是( )
| A. | NH4NO3 | B. | SiO2 | C. | 冰 | D. | O2 |
4.下列各种烷烃进行一氯取代反应后,只能生成三种沸点不同的有机产物的是( )
| A. | CH3CH2CH3 | B. | (CH3)2CHCH2CH3 | C. | CH3CH2CH2CH3 | D. | CH3(CH2)4CH3 |
11.有关化学用语正确的( )
| A. | 乙烯的结构式:C2H4 | B. | 四氯化碳的电子式: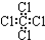 | ||
| C. | 甲烷分子的比例模型: | D. | 苯的分子式: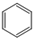 |
8. 固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
 固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )
固体离子导体依靠离子迁移传导电流,Ag+可以在RbAg4I5晶体中迁移.如图是一种固体电池.空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,I2和Ag作用形成原电池.下列说法中错误的是( )| A. | 该电池的反应方程式为I2+2Ag═2AgI | |
| B. | 石墨电极为正极,银电极为负极 | |
| C. | 正极的电极反应是:Ag-e-═Ag+ | |
| D. | 装置中电子移动的途径是:银电极→导线→石墨电极 |
9.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 12.4g白磷晶体中含有的P-P键数是0.4NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 2 mol SO2和1 molO2在一定条件下的密闭容器中反应,反应后分子总数大于2 NA | |
| D. | 1mol甲醇中含有C-H键的数目为4NA |