题目内容
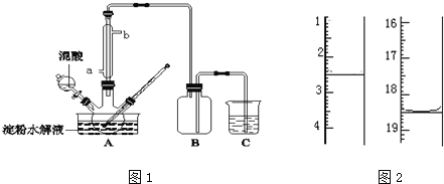
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl,可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | —114.1 | —57.5 | 58 | —138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)仪器 A 中发生反应的化学方程式是__________;装置B中的试剂是______。
(2)若撤去装置C,可能导致装置D中副产物_________ (填化学式)的量增加;装置D可采用__________加热的方法以控制反应温度在70℃左右。
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?____________。
(4)装置E中盛有NaOH溶液,写出该装置中所有可能发生的无机反应的离子方程式:_______________。
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol·L一1 碘标准溶液20.00mL,再加入适量 Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L一1Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为________。(CCl3CHO的相对分子质量为147.5) 滴定的反应原理:CCl3CHO+OH一 = CHCl3+HCOO一、 HCOO一 +I2 =H+ + 2I- + CO2↑、I2 + 2S2O32一 = 2I- +S4O62一
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 CCl3COOH 水浴 不可行,CCl3COOH溶于乙醇与CCl3CHO Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O 88.5%
MnCl2+Cl2↑+2H2O 饱和食盐水 CCl3COOH 水浴 不可行,CCl3COOH溶于乙醇与CCl3CHO Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O 88.5%
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl4CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气;
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;用饱和食盐水除去HCl;
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O;控制反应温度在70℃左右,应采取水浴加热;
(3)CCl3COOH溶于乙醇与CCl3CHO;
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,HCl与氢氧化钠反应生成氯化钠与水;
(5)根据消耗的Na2S2O3计算剩余I2的物质的量,进而计算与HCOO-反应的I2的物质的量,再根据关系式:CCl3CHO~HCOO-~I2计算。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl;
MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl;
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;饱和食盐水;
MnCl2+Cl2↑+2H2O;饱和食盐水;
(2)氯气能与水反应生成HCl与HClO,会发生:CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl、C2H5OH+HCl→C2H5Cl+H2O,导致装置D中副产物:CCl3COOH、C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,偏于控制温度,
故答案为:CCl3COOH;水浴;
(3)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离,
故答案为:不可行,CCl3COOH溶于乙醇与CCl3CHO;
(4)E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O;
(5)根据消耗的Na2S2O3计算
剩余I2的物质的量0.02000molL-1×0.02L×![]() =2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为
=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000molL-1×0.02L-2×10-4mol=1.8×10-3mol,由CCl3CHO~HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为![]() ×100%=88.5%,
×100%=88.5%,
故答案为:88.5%。

【题目】请回答以下问题
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=________。
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=________。
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10—5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①下列说法正确的是__________
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1molL-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1molL-1 HClO溶液和0.1molL-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO、CO32-、ClO-结合H+的能力由强到弱的顺序为___
③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:![]() =________
=________
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应10min后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式______。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是________。