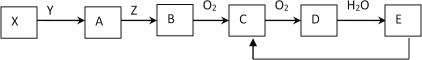
题目内容
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起有c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,稀释溶液可能引起由c向d的变化
D. 该温度下,加入FeCl3可能引起由b向a的变化
【答案】D
【解析】试题分析:A、温度升高,水的离子积增大,c(H+)、c(OH-)都增大,表示的点就不在曲线上,错误;B、水的离子积常数K=c(H+)·c(OH-),从图可知离子积是1.0×10-14,错误;C、温度不变水的离子积不变,稀释溶液后所表示的点还在曲线上,不可能引起由c向d的变化,错误;D、加入FeCl3,水解使得溶液酸性增强,c(H+)增大,那么c(OH-)减小,故可能引起由b向a的变化,正确。

【题目】钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4.82 |
890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..