题目内容
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:
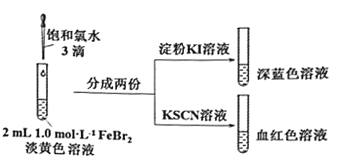
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:
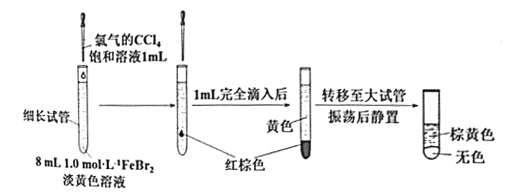
①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
【答案】 50mL容量瓶、烧杯(多答“量筒”亦可) Fe3+ 4Fe2++O2+4H+=4Fe3++2H2O Cl2+ 2Fe2+=2CL-+ 2Fe3+ 溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝 静置后,上层溶液为黄色,下层溶液无色 Br2 少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+
【解析】(1)①配制50mL1.0molL-1FeBr2溶液,步骤有计算,称量,溶解,转移,洗涤转移,定容,摇匀等,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、50mL容量瓶;②亚铁离子在溶液中易被空气中的氧气氧化为Fe3+,使溶液略显黄色,发生反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(2)①Cl2氧化Fe2+生成Fe3+发生反应的离子方程式是Cl2+ 2Fe2+=2C1-+ 2Fe3+;
②溶液中含有的Fe3+有强氧化性,也能氧化I-生成I2使淀粉变蓝,故乙同学认为不能证明Cl2和Br-发生反应;
③如果静置后,看到上层溶液为黄色说明溶液中含有Fe3+,下层溶液无色说明无Br2,即可证明少量Cl2只与Fe2+反应,不与Br-反应;
(3)①Br2的CCl4溶液呈红棕色,说明转移到大试管前CCl4液体中呈红棕色的物质是Br2;
②丙实验中先有Br2生成,后利用Br2氧化Fe2+得Fe3+,故丙实验可得结论是少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案