题目内容
为除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是
| A.NaOH | B.Na2CO3 | C.氨水 | D.MgO |
D
解析试题解析:A、加NaOH也会使Mg2+沉淀,错误;B、加Na2CO3不仅会使Mg2 +沉淀同时还引入了CO32-,错误;C、加氨水也会使Mg2+沉淀,错误;D、在加热搅拌下加MgO会促进Fe3+水解生成Fe(OH)3沉淀从而达到除杂的目的,正确,答案选D。
考点:考查离子的反应、水解、除杂等知识

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案某温度下,向一定体积0.1 mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)]的变化关系如图所示,则下列说法中错误的是
| A.M点所示溶液中c( NH4+)>c(Cl-) |
| B.Q点所示溶液的导电熊力强于M点 |
| C.Q点消耗盐酸的体积等于氨水的体积 |
| D.M点和N点所示溶液中水的电离程度相同 |
0.1 mol/L K2CO3溶液中,若要使c(CO32-)更接近0.1 mol/L,可采取的措施是
| A.加入少量盐酸 | B.加KOH固体 | C.加水 | D.加热 |
pH=2的两种一元酸X和Y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加0.1 mol/L NaOH至pH=7,消耗NaOH溶液的体积为Vx、Vy,下列说法正确的是
A.X为弱酸,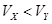 | B.Y为强酸,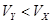 |
C.X为强酸, | D.Y为弱酸, |
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到
滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是:
A.浊液a中存在沉淀溶解平衡:AgCl(g) 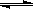 Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
在H2O+CH3COO- CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
| A.加入NaOH固体 | B.加入冰醋酸 | C.增大压强 | D.升高温度 |
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,促进水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是 ( )。
| A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32—)+c(OH-)+c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+c(HCO3—)+c(CO32—)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3—)=c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32—)>c(HCO3—)>c(H2CO3) |
常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是( )
| A.x=y | B.x >y | C.x=10-2y | D.x=102y |