题目内容
【题目】室温下向10mL 0.1molL﹣1 NaOH溶液中逐滴加入0.1molL﹣1的一元酸HA,溶液pH的变化曲线如图所示. 
(1)酸碱中和滴定时,用到的仪器有酸式滴定管、碱式滴定管、铁架台(带蝴蝶夹)、 .
(2)a点(横坐标为10)所示溶液中,溶质是 , 溶液中c(Na+)、c(A)、c(H+)、c(OH﹣)从大到小的顺序为 , 其中c(Na+)c(A﹣)+c(HA)(填“>”“<”或“=”)
(3)c点所示溶液中,c(Na+)c(A﹣)(填“>”“<”或“=”)
(4)b点所示溶液中,c(A﹣)c(HA)(填“>”“<”或“=”)
(5)a、b、c点所示溶液中,水的电离程度最大的是 .
(6)以下滴定操作会导致V(HA)偏大的是 . A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、最后一滴HA溶液附在锥形瓶内壁上未冲下
E、滴定开始前读数时平视,滴定终点,读数时俯视.
【答案】
(1)锥形瓶
(2)NaA;c(Na+)>c(A﹣)>c(OH﹣)>c(H+);=
(3)=
(4)>
(5)a
(6)A、D
【解析】解:(1)中和滴定需要用到铁架台(带蝴蝶夹)、酸式滴定管、碱式滴定管、锥形瓶;所以答案是:锥形瓶;(2)a点时酸碱恰好中和,溶质为NaA,NaA水解呈碱性,A﹣的水解程度减小,溶液中c(Na+)>c(A)>c(OH﹣)>c(H+);a点所示溶液中溶质为NaA,根据物料守恒可得:c(Na+)=c(A﹣)+c(HA);
所以答案是:NaA;c(Na+)>c(A﹣)>c(OH﹣)>c(H+);=;(3)c点所示溶液呈中性,则c(OH﹣)=c(H+),由电荷守恒得:c(Na+)+c(H+)=c(A﹣)+c(OH﹣);
所以c(Na+)=c(A﹣);
所以答案是:=;(4)b点溶质为等浓度的NaA和HA,HA的电离程度大于NaA的水解程度,c(A﹣)>c(HA);
所以答案是:>;(5)根据图像知,该酸是弱酸,a、b、c点的溶质分别是盐、盐和酸、盐和酸,a点盐类水解促进水电离,b点盐类水解小于酸的电离,水的电离程度受到抑制,c点溶液呈中性,水的电离程度不受影响,所以a、b、c三点溶液中水的电离程度最大的是a;
所以答案是:a;(6)A、滴定管滴定前有气泡,滴定后气泡消失,导致V(HA)偏大,故A正确;
B、锥形瓶洗涤后没有干燥,NaOH的物质的量不变,导致V(HA)不变,故B错误;
C、滴定时锥形瓶中有液体溅出,NaOH的物质的量偏小,导致V(HA)偏小,故C错误;
D、最后一滴HA溶液附在锥形瓶内壁上未冲下,导致V(HA)偏大,故D正确;
E、滴定开始前读数时平视,滴定终点,读数时俯视,导致V(HA)偏小,故E错误;
故选AD.
【考点精析】关于本题考查的酸碱中和滴定,需要了解中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能得出正确答案.

【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/gcm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
请回答下列问题: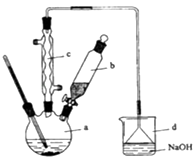
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.