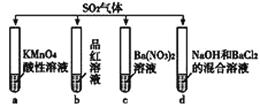
题目内容
【题目】写出以下反应的化学方程式:
(1)Na2O2与CO2反应:_______________
(2)加热使NaHCO3分解:____________
(3)Al与NaOH溶液反应:______________
(4)Fe(OH)2长时间露置于空气中:_____________
【答案】 2Na2O2 + 2CO2![]() 2Na2CO3 + O2 2NaHCO3
2Na2CO3 + O2 2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O 2Al + 2NaOH + 2H2O
Na2CO3 + CO2↑ + H2O 2Al + 2NaOH + 2H2O![]() 2NaAlO2 + 3H2↑ 4Fe(OH)2 + O2 + 2H2O
2NaAlO2 + 3H2↑ 4Fe(OH)2 + O2 + 2H2O ![]() 4Fe(OH)3
4Fe(OH)3
【解析】(1)Na2O2与CO2反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2 + 2CO2![]() 2Na2CO3 + O2;(2)加热使NaHCO3分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3
2Na2CO3 + O2;(2)加热使NaHCO3分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O;(3)Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al + 2NaOH + 2H2O
Na2CO3 + CO2↑ + H2O;(3)Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al + 2NaOH + 2H2O![]() 2NaAlO2 + 3H2↑;(4)Fe(OH)2长时间露置于空气中与氧气和水反应生成氢氧化铁,反应的化学方程式为:4Fe(OH)2 + O2 + 2H2O
2NaAlO2 + 3H2↑;(4)Fe(OH)2长时间露置于空气中与氧气和水反应生成氢氧化铁,反应的化学方程式为:4Fe(OH)2 + O2 + 2H2O ![]() 4Fe(OH)3。
4Fe(OH)3。

【题目】(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
实验 | 消耗0.1000molL﹣1的 | 待测氢氧化钠 |
1 | 29.02 | 25.00 |
2 | 28.01 | 25.00 |
3 | 27.99 | 25.00 |
(1)如图所示A的pH范围使用的指示剂是;
(2)用0.1000molL﹣1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是molL﹣1 . 在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。( )
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
A.0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B.Fe3+的作用是加快过氧化氢的分解速率
C.反应①是吸热反应、反应②是放热反应
D.反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0