题目内容
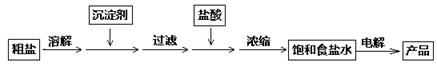
将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。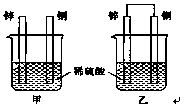
(1)以下叙述中,正确的是 (填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
(6分,每空2分)(1)B D (2)Zn + 2H+ =Zn2+ + H2↑ ; 6.5
解析试题分析:(1)根据装置图可判断,乙装置是原电池,发生电化学腐蚀。其中锌是负极,铜是正极。甲装置发生化学腐蚀,锌直接与稀硫酸反应,而铜不能反应,据此可以解答。
乙是原电池,其中铜是正极,溶液中的氢离子在正极放电放出氢气,故A错误;两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故B正确;乙是原电池,其中铜是正极,锌是负极,C不正确;通过原电池发生的反应速率要快于化学反应,选项D正确,因此答案选BD。
(2)装置乙中,总反应的离子方程式为Zn + 2H+ =Zn2+ + H2↑。若导线上通过0.2 mol电子,则根据电极反应式Zn-2e-=Zn2+可知,消耗锌的物质的量是0.1mol,质量为0.1mol×65g/mol=6.5g。
考点:考查原电池原理的有关判断、应用和计算
点评:该题是基础性试题的考查,难度不大。该题的关键是明确原电池的工作原理,特别是电极名称、电极反应式的书写,并能结合题意和装置图灵活运用即可。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
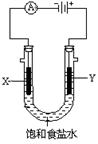
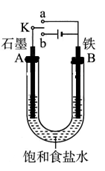
小学生10分钟应用题系列答案为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH?-4e?=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。
(1)b电极材料应为____,电极反应式为________________。
(2)电解液C可以是__________。
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
下列有关实验的叙述正确是( )
| A.将SO2通入溴水溶液中溴水褪色,可以说明SO2有漂白性 |
| B.将淀粉和稀硫酸混合后加热,再加入银氨溶液加热,可以检验淀粉水解后的产物 |
| C.将C2H5OH与浓硫酸170℃共热,制得的气体直接通入酸性KMnO4溶液,可以检验生成的乙烯气体 |
| D.向AgCl浊液中滴加KI溶液,白色沉淀转化为黄色沉淀,可以说明AgI比AgCl更难溶 |