题目内容
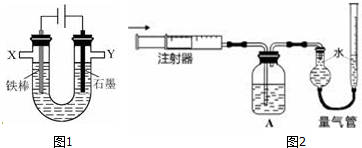
17.某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图1所示.实验一:电解饱和食盐水.
(1)配制饱和食盐水所需的玻璃仪器有:烧杯、量筒、玻璃棒.
(2)电解饱和食盐水的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.
实验二:电解不饱和食盐水及产物分析.
相同条件下,电解1mol•L-1NaCl溶液并收集两极产生的气体.在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解.结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅.经讨论分析,导致上述现象的原因有:
ⅰ.有部分Cl2溶于NaCl溶液中;ⅱ.有O2生成.
(3)设计实验证明有部分Cl2溶于NaCl溶液中.实验方案为:取少量石墨电极附近溶液,滴在淀粉KI试纸上,试纸变蓝
(4)证明有O2生成并测定O2的体积.按如图2所示装置进行实验,通过注射器缓缓地将在Y处收集到V2mL气体全部推入装置A(盛有足量试剂NaOH溶液)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得).
①装置A的作用是除去Cl2.
②本实验中,观察到量气管右侧液面上升的现象,说明石墨电极上有O2生成.
③实验中是否需要预先除尽装置中的空气?否(填“是”或“否”).
(5)实验二中,在石墨电极上产生的Cl2的总体积为v1-2v3mL(用代数式表示).
分析 实验一:电解饱和食盐水.
(1)配制饱和食盐水:在一定水中不能再溶解食盐固体时所得的溶液即为饱和食盐水,根据配制方法选择仪器;
(2)电解饱和食盐水阳极为氯离子失电子生成氯气,阴极为氢离子得电子生成氢气,生成氢氧化钠、氢气和氯气,据此书写;
实验二:电解不饱和食盐水及产物分析.
(3)根据氯气可使湿润的淀粉KI试纸变蓝判断;
(4)根据Y为阳极处收集到的V2mL气体中主要是氯气,所以证明有O2生成首先要除去氯气,当量气管的右侧液面上升,则说明含有氧气生成;根据本身的空气对压强不影响,所以实验中不需要预先除净装置中的空气;
(5)根据阴极X处收集到的氢气为V1mL气体,阳极Y处收集到为氯气和氧气,根据(4)最终量气管中收集到V3mL气体即氧气,设在石墨电极上生成Cl2的总体积为xml,则根据电解阴阳两极的得失电子守恒计算.
解答 解:实验一:电解饱和食盐水.
(1)一定水中不能再溶解食盐固体时所得的溶液即为饱和食盐水,所以配制饱和食盐水的操作为在烧杯中加入一定量的蒸馏水,边搅拌边加入食盐固体,直到固体不再继续溶解为止,所需的玻璃仪器有:烧杯、量筒、玻璃棒,
故答案为:玻璃棒;
(2)电解饱和食盐水阳极为氯离子失电子生成氯气,阴极为氢离子得电子生成氢气,化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
实验二:电解不饱和食盐水及产物分析.
(3)因为氯气可使湿润的淀粉KI试纸变蓝,所以证明有部分C12溶解于NaCl溶液中,可取少量石墨电极附近溶液,滴在淀粉KI试纸上,试纸变蓝,说明含有氯气,
故答案为:石墨;滴在淀粉KI试纸上,试纸变蓝;
(4)①因为Y为阳极处收集到的V2mL气体中主要是氯气,所以证明有O2生成首先要除去氯气,则装置A的作用是完全吸收氯气,除去Cl2,
故答案为:除去Cl2;
②当量气管的右侧液面上升,则说明含有氧气生成,
故答案为:量气管的右侧液面上升;
③本身的空气对压强不影响,所以实验中不需要预先除净装置中的空气,
故答案为:否;
(5)因为阴极X处收集到的氢气为V1mL气体,阳极Y处收集到为氯气和氧气,根据(4)最终量气管中收集到V3mL气体即氧气,设在石墨电极上生成Cl2的总体积为xml,则根据电解阴阳两极的得失电子守恒,V1×2=x×2+V3×4,所以x=V1-2V3,
故答案为:v1-2v3.
点评 本题主要考查了电解饱和食盐水产物的探究,涉及到溶液的配制、方程式的书写、电极产物的检验依据误差的分析与探究,综合性较强,题目难度中等.

 阅读快车系列答案
阅读快车系列答案①肯定含I- ②肯定含SO32- ③肯定含NH4+ ④可能含I- ⑤一定不含Cu2+.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③④⑤ |
| A. | ②④ | B. | ②④⑥ | C. | ①④⑤ | D. | ②④⑤ |
| A. | 2L氯化氢气体分解成1L的氢气和1L的氯气,吸收183kJ热量 | |
| B. | 1mol氢气与1mol氯气反应生成2mol液态氯化氢放出的热量小于183kJ | |
| C. | 在相同条件下,1mol氢气与1mol氯气的能量总和大于2mol氯化氢气体的能量 | |
| D. | 1个氢气分子与1个氯气分子反应生成2个氯化氢分子放出183kJ热量 |
| A. | 苯和甲苯 | B. | 己烷和苯 | C. | 乙烯和丙烯 | D. | 乙烯和丙炔 |
| A. | 工业上将石油蒸馏得到汽油,这主要发生了化学变化 | |
| B. | 区分蛋白质溶液和葡萄糖溶液可利用丁达尔效应 | |
| C. | 乙醇汽油是一种化合物,具有可燃性 | |
| D. | 食醋、纯碱、食盐的主要化学物质分别属于酸、碱、盐 |
(1)直接排放含SO2的烟气会形成酸雨,危害环境.用化学方程式表示SO2形成硫酸型酸雨的过程SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4或2SO2+O2$\stackrel{浮尘}{?}$2SO3、SO3+H2O=H2SO4.
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量.请你分析雨后或风速较大时SO2平均含量较低的原因:
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨前 | ||
| 雨后 | ||
| 晴 | ||
| 晴 |
②风速较大时:风速越大,气体扩散速度越快,空气中SO2浓度越小.
(3)洗涤含SO2的烟气.以下物质不能作为洗涤剂的是cd(填字母序号).
a.熟石灰 b.纯碱c.CaCl2d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:FeS2$→_{+O_{2}+H_{2}O}^{在微生物作用下}$Fe2++SO42-Fe2+
①该技术的第一步反应的离子方程式为2FeS2+7O2+2H2O=4H++2Fe2++4SO42-.
②处理1kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为37.352L(保留一位小数).
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图1所示.由图可知,光化学烟雾是指O3、醛、PAN
等污染物气体和颗粒物所形成的烟雾.

(6)氧化-还原法消除NOx的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
①反应Ⅰ为NO+O3=NO2+O2,生成11.2L O2(标况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(7)利用氨水可以将SO2和NO2吸收,原理如图2所示:
NO2被吸收的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+..