题目内容
2.下列各组物质能用酸性高锰酸钾溶液鉴别的是( )| A. | 苯和甲苯 | B. | 己烷和苯 | C. | 乙烯和丙烯 | D. | 乙烯和丙炔 |
分析 选项中乙烯、乙炔均能被酸性高锰酸钾氧化,而苯、己烷等均不与酸性高锰酸钾反应,以此来解答.
解答 解:A.苯与高锰酸钾不反应,甲苯可被酸性高锰酸钾氧化,故A正确;
B.己烷和苯与高锰酸钾都不反应,不能用于鉴别,故C错误;
C.乙烯和丙烯都含有碳碳双键,都被酸性高锰酸钾氧化,故C错误;
D.乙烯和丙炔都含有碳碳不饱和键,都被酸性高锰酸钾氧化,故D错误.
故选A.
点评 本题考查有机物的鉴别,侧重常见有机物性质的考查,为高频考点,注意利用不同现象鉴别物质,选项B为解答的易错点,题目难度不大.

练习册系列答案
相关题目
12.在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L-1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |
13.成语“恶狗酒酸”中隐藏着一个寓言故事:人有市酒而甚美者,然至酒酸而不售,问里人其故.里人曰:公之狗甚狂,人有持器往者,狗辄迎面啮之,是以酒酸不售也. 下列关于“酒”的说法错误的是( )
| A. | “恶狗酒酸”的成语中涉及了氧化反应 | |
| B. | 糖类、油脂都可以用来酿酒 | |
| C. | 葡萄糖转变成酒精的过程放出热量 | |
| D. | 工业酒精中因含有剧毒物质甲醇而不能用来勾兑饮用酒水 |
10.海水中含有丰富的镁资源.锂(Li)与镁元素性质相似.
(1)某同学设计了从模拟海水中制备MgO的实验方案:
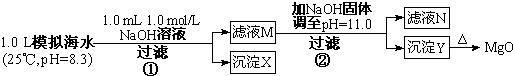
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12
请回答:沉淀物X为CaCO3(写化学式);滤液N中存在的金属阳离子为Ca2+、Na+,;
步骤②中若改为加入 4.2gNaOH固体,沉淀物Y为Mg(OH)2(写化学式).
(2)物质的量为0.10mol的锂在只含有CO2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是0.7g<m<1.5g;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池.某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,则放电时电池的正极反应为CoO2+Li++e-=LiCoO2.
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂.
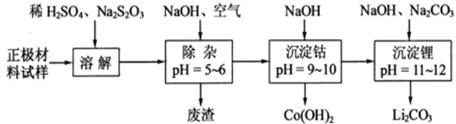
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4.
②调整PH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.
(1)某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12
请回答:沉淀物X为CaCO3(写化学式);滤液N中存在的金属阳离子为Ca2+、Na+,;
步骤②中若改为加入 4.2gNaOH固体,沉淀物Y为Mg(OH)2(写化学式).
(2)物质的量为0.10mol的锂在只含有CO2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是0.7g<m<1.5g;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池.某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,则放电时电池的正极反应为CoO2+Li++e-=LiCoO2.
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂.

①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4.
②调整PH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.
7.NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 7.8g过氧化钠晶体中含有0.1NA个O${\;}_{2}^{2-}$ | |
| C. | 标准状况下,22.4LNO2中含有NA个NO2分子 | |
| D. | 1mol•L-1NH4Cl溶液中,NH${\;}_{4}^{+}$的数目小于NA |
12.设NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 常温常压下18g水中含有的原子总数为3NA, | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| C. | 标准状况下2.24LH2O中所含电子数为NA | |
| D. | 常温常压下,1.7gH2O2中含有的电子数为0.9NA |