题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
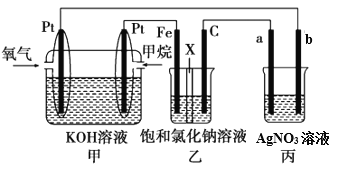
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因__________________________________
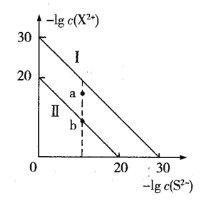
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
【答案】CH4-8e-+10OH-=CO32-+7H2O 2H2O+2e-= H2+2OH-,使溶液呈碱性 0.4mol Ag
【解析】
(1)甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(2)根据装置可知,甲池中通入甲烷的一极为负极,则乙池中连接负极的铁电极为阴极;
(3)串联电池中转移电子数相等;
(4)欲用丙装置给铜镀银,b连接燃料电池的正极,为阳极,应是镀层金属Ag。
(1)甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O;
(2)根据装置可知,甲池中通入甲烷的一极为负极,则乙池中连接负极的铁电极为阴极,向乙中加入几滴酚酞溶液,工作一段时间后铁电极上水电离出的氢离子得电子产生氢气,电极反应为2H2O+2e-= H2+2OH-,附近溶液中氢氧根离子浓度增大,使溶液呈碱性,溶液变红;
(3)串联电池中转移电子数相等,若在标准状况下,有4.48 L氧气参加反应,则转移电子的物质的量=![]() ×4=0.8mol,乙装置中C电极上氯离子放电生成氯气,设生成氯气的物质的量为x;
×4=0.8mol,乙装置中C电极上氯离子放电生成氯气,设生成氯气的物质的量为x;
2Cl-+2e-=Cl2↑
2mol 1mol
0.8mol x
x=0.4mol;
(4)欲用丙装置给铜镀银,b连接燃料电池的正极,为阳极,应是镀层金属Ag。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验操作对应的现象不符合事实的是
选项 | 实验操作 | 现象 |
A | 向盛有 | 溶液逐渐变为黄色,滴加KSCN后溶液变血红色 |
B | 向盛有 | 溶液逐渐褪色,静置后观察到溶液有分层现象 |
C | 向 | 先产生白色沉淀,后沉淀消失 |
D | 向盛有 | 有刺激性气味气体产生,溶液变浑浊 |
A.AB.BC.CD.D