题目内容
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为 11℃,可用于处理含硫废水。某小组在实验室中探究 ClO2 与 Na2S 的反应。回答下列问题:
(1)ClO2 的制备
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
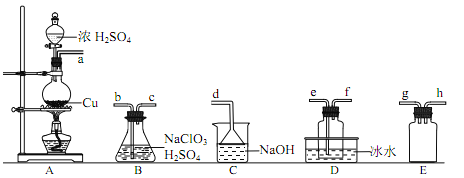
①装置 A 中反应的化学方程式为____________。
②欲收集干燥的 ClO2,选择上图中的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)
③装置 D 的作用是__________________。
(2)ClO2 与 Na2S 的反应
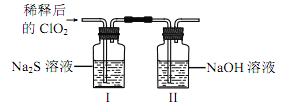
将上述收集到的 ClO2 用 N2 稀释以增强其稳定性,并将适量的稀释后的 ClO2 通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
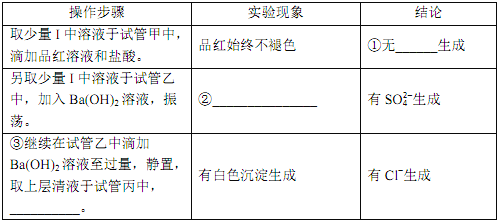
①___________。②___________。③___________。
④ClO2 与 Na2S 反应的离子方程式为____________。用于处理含硫废水时,ClO2 相对于Cl2 的优点是____________(任写一条)。
【答案】 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O g→h(或h→g)→b→c→e→f→d 冷凝并收集ClO2 SO2(答HSO3-、SO32-、SO2和SO32-、SO2和HSO3-、HSO3-和SO32-、及SO2和SO32-、HSO3-均给分) 生成白色沉淀(没有答“白色”不给分) 加入足量稀硝酸酸化的硝酸银溶液 8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+ ClO2除硫效果彻底,氧化产物硫酸根稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染。均被还原为Cl-时,二氧化氯得到的电子数是氯气的2.5倍。
CuSO4+SO2↑+2H2O g→h(或h→g)→b→c→e→f→d 冷凝并收集ClO2 SO2(答HSO3-、SO32-、SO2和SO32-、SO2和HSO3-、HSO3-和SO32-、及SO2和SO32-、HSO3-均给分) 生成白色沉淀(没有答“白色”不给分) 加入足量稀硝酸酸化的硝酸银溶液 8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+ ClO2除硫效果彻底,氧化产物硫酸根稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染。均被还原为Cl-时,二氧化氯得到的电子数是氯气的2.5倍。
【解析】(1)①装置A中反应Cu与浓硫酸制备二氧化硫,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+H2O;故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O;故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+H2O;
CuSO4+SO2↑+H2O;
②二氧化硫从a进入装置B中反应,为防止倒吸,故应在之前有安全瓶,则a→g→h,为反应充分,故再连接B装置中的b,二氧化氯沸点较低,故在D中冰水浴收集,为充分冷却,便于收集,故连接e,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:a→g→h→b→c→e→f→d;故答案为:g→h→b→c→e→f→d;
③装置D的作用为冷凝并收集ClO2;故答案为:冷凝并收集ClO2;
(2)将适量的稀释后的ClO2通入如图2所示装置中充分反应,得到无色澄清溶液。
①取少量I中溶液于试管甲中,滴加品红溶液和盐酸,品红始终不褪色,说明溶液中无SO2(或HSO3-或SO32-)生成;故答案为:SO2(或HSO3-或SO32-);
②另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡,有SO42-生成,硫酸根与钡离子反应生成硫酸钡白色沉淀;故答案为:生成白色沉淀;
③结论为有Cl-生成,有白色沉淀生成,氯化银为不溶于酸的白色沉淀,检验氯离子,故操作为:继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内加入足量稀硝酸酸化的硝酸银溶液;故答案为:加入足量稀硝酸酸化的硝酸银溶液;
④由上述分析可知ClO2与Na2S反应有氯离子、硫酸根离子的生成,故发生的离子方程式为:8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2除硫效果彻底,氧化产物硫酸根更稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染、均被还原为氯离子时,ClO2得到的电子数是氯气的2.5倍;故答案为:8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2除硫效果彻底,氧化产物硫酸根更稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染、均被还原为氯离子时,ClO2得到的电子数是氯气的2.5倍。