题目内容
【题目】下列描述中正确的是( )
A. ClO3-的空间构型为平面三角形
B. 乙炔分子中的两个碳原子采用sp2杂化方式
C. CS2为V形的极性分子
D. SiF4和SO32-的中心原子均为sp3杂化
【答案】D
【解析】A.ClO3-中Cl的价层电子对数=3+![]() (7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故A错误;B.乙炔分子中每个碳原子含有2个σ键且不含孤电子对,所以采取sp杂化,故B错误;C.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故C错误;D.SiF4中Si的价层电子对数=4+
(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故A错误;B.乙炔分子中每个碳原子含有2个σ键且不含孤电子对,所以采取sp杂化,故B错误;C.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故C错误;D.SiF4中Si的价层电子对数=4+![]() (4-1×4)=4,SO32-中Si的价层电子对数=3+
(4-1×4)=4,SO32-中Si的价层电子对数=3+![]() (6+2-2×3)=4,所以中心原子均为sp3杂化,故D正确;答案为D。
(6+2-2×3)=4,所以中心原子均为sp3杂化,故D正确;答案为D。

【题目】磺化钠在医药中用作甲状腺肿瘤防治剂、袪痰剂和利尿剂,也用作食品添加剂、感光剂等。工业上用水合肼(N2H4·H2O)还原法制取碘化钠固体,其制备流程如图所示:
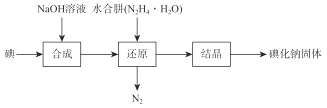
己知:N2H4·H2O在100℃以上分解。
(1)在合成NaI的过程中,可能混有的物质是_______,生产过程中要适当补充NaOH,目的是________。
(2)在还原过程中,为了防止水合肼(N2H4·H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是___________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_____________________。
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:__________________。(可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液)
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000 g样品并溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol·L-1的Na2S2O3溶液滴定至终点(发生反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
测定序号 | 待测体积/ml | 盛装标准滴定管的起点读数/ml | 盛装标准滴定管的终点读数/ml |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①在滴定过程中,Na2S2O3溶液应放___________(填仪器)中;加入的A物质为____________(填名称)。
②滴定终点观察到的现象为_______________________。
③该样品中NaI的含量为_______________________。
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是_________________。
(5)碘化钠固体的保存方法是_______________________。