题目内容
【题目】在A、B两个恒容密闭容器中发生反应:2NO2![]() 2NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示。
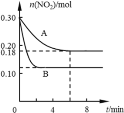
(1)若A容器的体积为5 L,反应经6 min达到平衡状态。0~6 min内用O2浓度变化表示的反应速率为___________________。
(2)写出该反应的化学平衡常数K的表达式:______________________。
(3)说明该反应已达到平衡状态的是_______。
a.v正(NO2)=v逆(NO) b.c(NO2)= c(NO)
c.气体的平均摩尔质量不变 d.气体的密度保持不变
(4)若A、B两容器中只有一个反应条件不同(温度),比较下列物理量。(填“>”、“=”或“<”)
温度 | 反应速率 | 反应的平衡常数 | 反应的热效应(△H) |
TA____TB | vA____vB | KA____KB | △H ____0 |
(5)任写两种能提高二氧化氮转化率的措施_________________、___________________。
【答案】0.002 mol/(Lmin) K=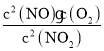 ac < < < > 升高温度 增大压强
ac < < < > 升高温度 增大压强
【解析】
(1)根据NO2的物质的量结合方程式可判断平衡时O2的浓度,进而计算O2的反应速率;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积书写平衡常数表达式;
(3)达到平衡时存在“等”、“定”的特征,由此判断平衡状态;
(4)根据图像,B先达到平衡状态,说明B的反应速率大,据此分析判断反应速率、温度、平衡常数的变化;
(5)要提高二氧化氮转化率,需要平衡正向移动,结合方程式分析判断。
(1)根据图象可知,A容器中,平衡时NO2的物质的量为0.18mol,则反应的NO2的物质的量为0.12mol,生成O2的物质的量为0.06mol,则VO2= =0.002 mol/(Lmin),故答案为:0.002 mol/(Lmin);
=0.002 mol/(Lmin),故答案为:0.002 mol/(Lmin);
(2)2NO2![]() 2NO +O2的平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=
2NO +O2的平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=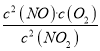 ,故答案为:K=
,故答案为:K=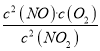 ;
;
(3)a.V正(NO2)=V逆(NO),说明正、逆反应速率相等,反应达到平衡状态,故a正确;b.c(NO2)=c(NO),不能说明浓度是否变化,不能说明达到平衡状态,故b错误;c.气体的质量始终不变,但物质的量发生变化,当气体的平均摩尔质量不变,说明气体的物质的量不变,说明反应达到平衡状态,故c正确;d.由于气体的质量不变,气体的体积不变,则无论是否达到平衡状态,都存在气体的密度保持不变的特征,不能判断是否达到平衡,故d错误;故答案为:ac;
(4)若A、B两容器中只有一个反应条件不同(温度),根据图像,B先达到平衡状态,说明B的反应速率大,即vA<vB,因此TA<TB;B平衡时NO2的物质的量小于A平衡时NO2的物质的量,说明升高温度,平衡正向移动,平衡常数增大,即KA<KB,该反应的正反应为吸热反应,△H>0,故答案为:<;<;<;>;
(5)要提高二氧化氮转化率,需要平衡正向移动,可以采取的措施有:升高温度、增大压强等,故答案为:升高温度;增大压强。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案