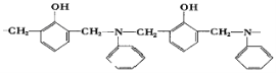
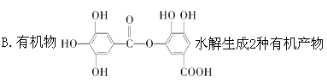
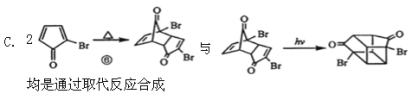
��Ŀ����
����Ŀ������������л�������֮һ���Dz��鶯���ijЩ�������ڵ����ʴ�л�ֽ����Ҫ�����ղ��
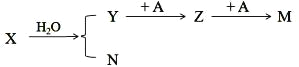
(1)����[(NH2)2CO]�Ǻ�������ߵĹ��嵪�ʣ������ۺ�����Ϊ________%������ 1 λС������������ N �Ļ��ϼ�Ϊ________.
(2)������̼�����ڸ��¡���ѹ�ºϳɰ�������泥�����������ٷ����ֽⷴӦ�ɵõ����ء�д���÷ֽⷴӦ�Ļ�ѧ����ʽ��____________________________��
(3)��������(NH2)2CO ˮ��Һ���յ������� NOx�����չ����д��� HNO2 ��(NH2)2CO ���� N2 ��CO2 �ķ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________________ ������ 1 mol N2 ʱ��ת�Ƶĵ�����Ϊ __________ .
(4)Ҳ����ˮ���յ������� NOx����֪ NO2 ����ˮ������Ȼ�ѧ����ʽ���£�
2NO2��g��+H2O��l��![]() HNO3��aq��+HNO2��aq�� ��H=116.1 kJ��mol1
HNO3��aq��+HNO2��aq�� ��H=116.1 kJ��mol1
3NO2��g��+H2O��l��![]() 2HNO3��aq��+NO��g�� ��H=136.2kJ��mol1��
2HNO3��aq��+NO��g�� ��H=136.2kJ��mol1��
����ϡ��������NO�ķ�ӦHNO3��aq��+2NO��g��+H2O��l��=3HNO2��aq����H=___kJ��mol1
���𰸡�46.7% ��3 NH2-COONH4 = (NH2)2CO+H2O 2HNO2+(NH2)2CO = 2N2��+ CO2��+3H2O 3NA 75.9
��������
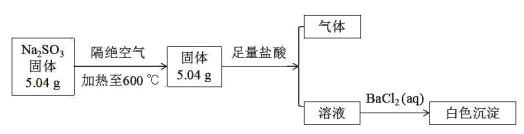
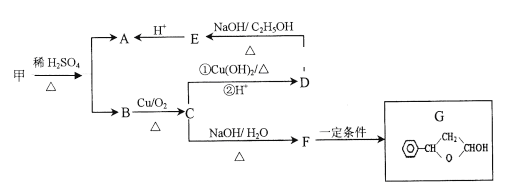
(1)����[(NH2)2CO]�����ۺ��������������е�Ԫ�ص��������������ؽṹʽΪ![]() ����ͼ��֪��ÿ��Nԭ���γ��������Թ��ۼ���N�ķǽ�����ǿ��C��H�����Ӷ�ƫ��ԭ�ӣ�NΪ-3�ۡ�
����ͼ��֪��ÿ��Nԭ���γ��������Թ��ۼ���N�ķǽ�����ǿ��C��H�����Ӷ�ƫ��ԭ�ӣ�NΪ-3�ۡ�
(2) ���л���������������ŵĽṹ��д����������淋Ļ�ѧʽΪ�� H2N-COONH4���ٸ��������������أ����������غ㶨��д����Ӧ����ʽ��
(3)��Ӧ��Ϊ HNO2 ��(NH2)2CO ���������� N2 ��CO2 �����������غ�͵�ʧ�����غ���д����ʽ�����ݵ���ת����Ŀ���㵱���� 1 mol N2 ʱ��ת�Ƶĵ�������
(4)�ɸ�˹���ɵó�Ŀ�귴Ӧ���ʱ䡣
(1)CO(NH2)2 �е�Ԫ�صİٷֺ���Ϊ�� 2��14/(12+16+28+4)=0.467 ���������ϵ���ֵ,һ������ 46.7%��, ��Ϊ�������ʣ����صĽṹ��ʽΪ H2N-CO-NH2,�ɻ��ϼ۹���֪̼�뵪��ʱ��Ϊ���ۣ�����̼��ʱ��Ϊ���ۣ���������ʱ��Ϊ���ۣ�CO(NH2)2 �� C �ǣ�4 �ۣ�O �ǣ�2�ۣ�H �ǣ�1 �ۣ�N ��-3 �ۡ���Ϊ��46.7% ����3��
(2)���л���������������ŵĽṹ֪������������� H2N-COONH4���������غ�֪�����ֽⷴӦ�õ����غ�ˮ H2N-COONH4 = (NH2)2CO+H2O ����Ϊ��NH2-COONH4 = (NH2)2CO+H2O��
(3) ��ȷ��Ԫ�صĻ��ϼ��ǽ�����С���ǰ�ᣬ�ɵ�ʧ�����غ��������غ����ƽ��Ӧʽ 2HNO2+(NH2)2CO = 2N2+ CO2 +3H2O�����ó����� 1 mol N2 ʱ��ת�Ƶĵ���Ϊ 3mol����Ϊ��2HNO2+(NH2)2CO = 2N2��+ CO2��+3H2O��3NA ��
(4)�ɸ�˹����֪������֪�� 3����Ӧ1��ȥ2����Ӧ2 ���ɵ�Ŀ�귴Ӧ ���ʡ� H=3����116.1 kJ��mol1) 2��(136.2kJ��mol1) =75.9 kJ��mol1����Ϊ��75.9��