题目内容
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中B、E为金属单质,D为气体。反应① ②是置换反应,反应① ② ③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
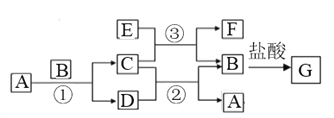
(1)C的化学式_____________, E与足量盐酸反应的离子方程式_________________;
(2)反应③ 化学方程式_______________________;E加入过量的NaOH溶液对应离子反应方程式_______________________;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式_________________;
(4)F与氢氧化钠反应的化学方程式为_____________________________。
【答案】 Fe3O4 2Al +6H+=2Al3++3H2↑ 8Al+3Fe3O4![]() 9Fe+4Al2O3 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++H2O2+2H+=2Fe3++2H2O Al2O3+2NaOH=2NaAlO2+H2O
9Fe+4Al2O3 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++H2O2+2H+=2Fe3++2H2O Al2O3+2NaOH=2NaAlO2+H2O
【解析】A为常温下最常见的液体,A是水。C有磁性,A与B反应生成C和D,B、E为金属单质,D为气体。反应①、②是置换反应,且反应①、②、③均在高温下进行,所以B是铁,C是四氧化三铁,D是氢气。E、F既能溶于NaOH又能溶于HCl,所以E是铝,F是氧化铝,铁与盐酸反应生成氯化亚铁和氢气,则G是氯化亚铁。
(1)根据以上分析可知C的化学式为Fe3O4;铝与足量盐酸反应的离子方程式为2Al+6H+=2Al3++3H2↑;(2)反应③是铝热反应,反应的化学方程式为8Al+3Fe3O4![]() 9Fe+4Al2O3;铝与过量的NaOH溶液反应的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)G溶液中加入酸性的H2O2溶液后变黄色,说明亚铁离子被双氧水氧化,反应的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(4)氧化铝与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
9Fe+4Al2O3;铝与过量的NaOH溶液反应的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)G溶液中加入酸性的H2O2溶液后变黄色,说明亚铁离子被双氧水氧化,反应的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(4)氧化铝与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。

【题目】在一定温度下,将气体X和气体Y 各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣3 mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1: 己知:A中放有浓硫酸;B中放有乙醇、无水碳酸钠;D中放有饱和碳酸钠溶液.
有关有机物的沸点.
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用:催化剂和;反应中加入过量的乙醇,目的是 .
(2)仪器C的名称是 , 其作用有冷凝乙酸乙酯和 , 若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为 .
(3)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: .
(4)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图: 
则试剂a是: , 试剂b是: . 分离方法I是 , 分离方法II是
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功. 试解答下列问题:
①甲实验失败的原因是: .
②乙实验失败的原因是: .
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g)CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示),
△H3═(用△H1、△H2表示);根据反应③判断△S0(填“>”、“=”或“<”),在(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.降低温度
E.使用合适的催化剂
F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL﹣1、0.3molL﹣1、0.3molL﹣1、0.15molL﹣1 , 则此时v正v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是 . 
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线. 

